题目内容
【题目】已知反应H2(g)+ ![]() O2(g)=H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是 ( )
O2(g)=H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是 ( )
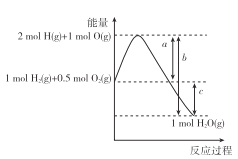
A. H2(g)+ ![]() O2(g)=H2O(g) △H=c kJ·mol-1
O2(g)=H2O(g) △H=c kJ·mol-1
B. 2H2O(g)=2H2 (g)+O2 (g) △H=—2(a-b) kJ·mol-1
C. 1 mol氢气与0.5 mol氧气总能量为akJ
D. 2 mol氢气与1 mol氧气完全反应生成2 mol液态水放出的热量小于2(b-a)kJ
【答案】B
【解析】A、反应物的能量更高,该反应为放热反应,△H=-c kJ·mol-1,A错误。B、2molH2O逆向分解时,共吸收2bkJ能量,又释放2akJ能量得到产物,△H=-2(a-b) kJ·mol-1,B正确。C、图中标示了1 mol氢气与0.5 mol氧气总能量,但是在纵坐标中没有具体可用的读数,akJ 是由此变化到气态原子时的能量变化,C错误。D、如果反应生成液态水,释放的能量更大,所以2 mol氢气与1 mol氧气完全反应生成2 mol液态水放出的热量大于2(b-a)kJ,D错误。正确答案B。

 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:______。
(2)实验结果表明,催化剂的催化效果与_____有关。
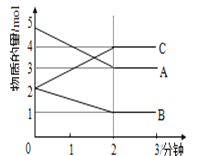
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是_____。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
(4)该反应的的化学方程式为__________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)能说明该反应已达到平衡状态的是____。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数______。