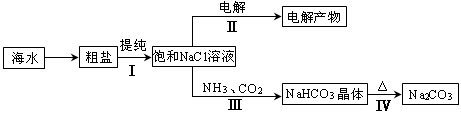
题目内容
研究NO2.SO2.CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 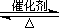 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1
(ⅰ)则反应NO2(g)+SO2 (g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B.体系压强保持不变
C.混合气体颜色保持不变 D. SO3和NO的体积比保持不变
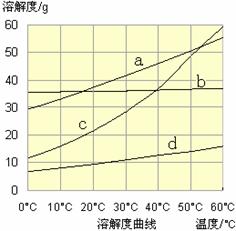
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。
平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”.“<”或“=”)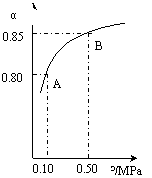
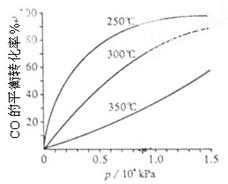
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
(1)0.8NA 86.7 (2) (i)-41.8(ⅱ)C (ⅲ)= (3)<
解析试题分析:
(1)二式相加,除以2得到新式子:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ,每消耗0.1molCH4,转移0.8NA电子; 物质和能量是紧密相连的,以物质为基础,物质怎么变,能量就怎么变,两式直接相加,除以2,CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-173.4 kJ·mol-1,放出热量86.7kJ;
(2)(ⅰ)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO, △H="-83.6" kJ?mol-1,故NO2+SO2?SO3+NO,△H="-41.8" kJ?mol-1;(ⅱ)平衡标志,有直接标志,正逆速率相等、各组分浓度保持不变;间接标志遵循变化着的量不再改变,反应即平衡。二氧化氮为红棕色气体,颜色不再改变,反应即平衡。(ⅲ)化学平衡常数是个温度常数,温度不变,化学平衡常数不变。
(3))由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸
热反应,正反应是放热反应,△H<0;
考点:该题将元素化合物与能量变化、化学平衡等知识柔和在一起进行考察,充分体现了高考的综合性,第(3)容易出错,需认真分析图象,注意图象的变化趋势及纵横坐标的含义,从而得出正确结论。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
| A.向平衡混合物中充入Ar | B.向平衡混合物中充入O2 |
| C.改变反应的催化剂 | D.降低反应的温度 |
 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。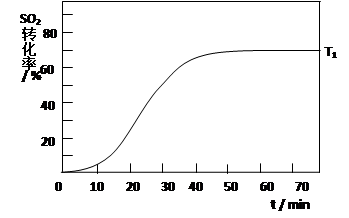
氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知: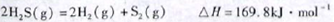
下列有关该反应的叙述正确的是
| A.正反应活化能小于169.8kJ·mol-1 |
| B.逆反应活化能一定小于169.8kJ·mol-1 |
| C.正反应活化能不小于169.8kJ·mol-1 |
| D.正反应活化能比逆反应活化能小169.8kJ·mol-1 |
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示。在4000℃~5000℃时可能发生下列哪些反应 (填写字母)。
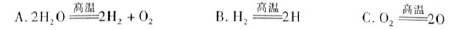
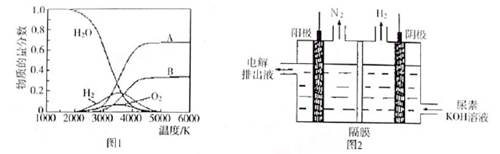
(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。该电解装置中电解排出液中的主要成分是 (写化学式)。
(5)已知下列物质的KSP:
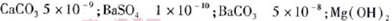
5.6×10-12;Ca(OH)2;1.4×10-5。氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42—[c(SO42—)>c(Ca2+)]。某精制流程如下:
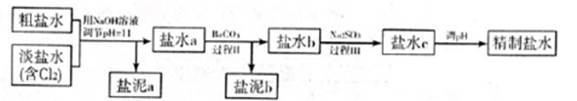
①盐泥a除泥沙外,还含有的物质是 。
②过程I中将NH4+转化为N2的离子方程式是 。
③过程II中除去的离子有 。
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L。若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液 kg(溶液体积变化忽略不计)
(7分)(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235.8" kJ/mol;
己知:2 Ag2O(s)===4Ag(s)+O2(g);△H = +62.2kJ/mol;
则反应 2O3(g)= 3O2(g) 的△H = kJ/mol;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产
生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。 (2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下: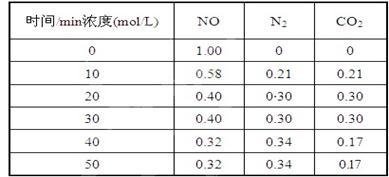
①在10 min~20 min的时间段内,以CO2表示的反应速率为 ;
②写出该反应的平衡常数的表达式K= ;
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
| A.容器内压强保持不变 | B.2v正(NO)=v逆(N2) |
| C.容器内CO2的体积分数不变 | D.混合气体的密度保持不变 |
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4 Na(g)+ 3CO2(g)
 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1680℃,若反应时间为10min, 金属钠的物质的量减少了0.20mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
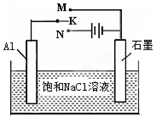
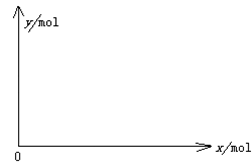
(5)下图开关K接M时,石墨作 极,电极反应式为 。K接N一段时间后测得有0.3mol电子转移,作出y随x变化的图象〖x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据〗
 3N2+2X+4H2O
3N2+2X+4H2O  2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
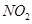 、
、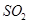 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使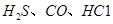 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知: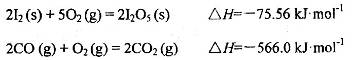
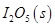 反应生成
反应生成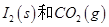 的热化学方程式:________________。
的热化学方程式:________________。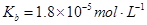

 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)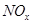 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将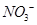 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。