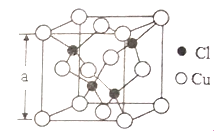
��Ŀ����
����Ŀ����N2�� H2��һ��������ϣ�����ͬ״�������ܶ���H2��3.6����ȡ0.5mol�û������ͨ���ܱ������ڣ�ʹ֮������Ӧ����һ�������´ﵽƽ�⣮��֪��Ӧ�ﵽƽ���������ѹǿ����ͬ�����·�Ӧǰѹǿ��0.76��������
��1����Ӧǰ��������ƽ����Է�������Ϊ������N2�� H2������ȵ�����
��2���ﵽƽ��ʱ��������еİ������ʵ�������
��3��ƽ��ʱN2��ת���ʵ���
���𰸡�
��1��7.2��1��4
��2��0.12mol
��3��60%
���������⣺��1��N2�� H2��һ��������ϣ�����ͬ״�������ܶ���H2��3.6������ƽ����Է�������Ϊ3.6��2=7.2��
�赪��Ϊxmol������Ϊymol���� ![]() =7.2�����x��y=1��4��
=7.2�����x��y=1��4��
��ͬ���������ʵ���֮�ȵ������֮�ȣ��������Ϊ1��4��
���Դ��ǣ�7.2��1��4��
�ɣ�1����֪��0.5mol�û�����壬���ʵ����ֱ�Ϊ0.1mol��0.4mol����
3H2 | + | N2 | 2NH3 | ||
��ʼ | 0.4 | 0.1 | 0 | ||
ת�� | 3n | n | 2n | ||
ƽ�� | 0.4��3n | 0.1��n | 2n |
�ﵽƽ���������ѹǿ����ͬ�����·�Ӧǰѹǿ��0.76������![]() =0.76��
=0.76��
���n=0.06mol����2������ƽ������ʵ���Ϊ2��0.06mol=0.12mol�����Դ��ǣ�0.12mol����3��������ת����Ϊ ![]() ��100%=60%�����Դ��ǣ�60%��
��100%=60%�����Դ��ǣ�60%��
�����㾫����������Ҫ�����˻�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮

 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�