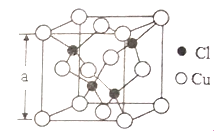
题目内容
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A.当有0.1 mol电子转移时,a极产生1.12 L O2(标况)
B.b极上发生的电极反应是:2H![]() + 2e- = H2↑
+ 2e- = H2↑
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
【答案】D
【解析】
试题分析:由图可知左边是电解池,右边是原电池,ab是电解池的电极,由电源判断a为阴极产生氢气,b为阳极产生氧气;cd是原电池的正负极,c是正极,d是负极; A、当有0.1 mol电子转移时,a电极为阴极,发生反应:4H + +4e - =2H 2 ↑,产生1.12LH 2 ,A错误;B、b电极为阳极,发生反应:4OH - -4e - =2H 2 O+O 2↑,B错误;C、d为负极,发生反应:2H 2 -4e - =4H + ,C错误;D、c电极为正极,得到电子发生还原反应:O 2 +4H + +4e - =2H 2 O,d为负极,发生反应:2H 2 -4e - =4H + ,B中的H + 可以通过隔膜进入A,D正确。答案选D。

【题目】FeCl3,又名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_______________________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_______mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =_______mol/L.
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为__________________;高铁酸钠Na2FeO4是一种新型水处理剂,用FeCl3制备的离子方程式如下,请完成该方程式的配平:___Fe3++_____Cl 2+_____OH-=_____FeO42-+_____Cl-+_____H2O
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
A | B | C | |
加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
加入钠 | 放出氢气 | 放出氢气 | 不反应 |
苯环上一氯代物的种数 | 2 | 3 | 3 |
则B的结构简式为____,A与浓溴水反应的方程式为___________。