题目内容
【题目】氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
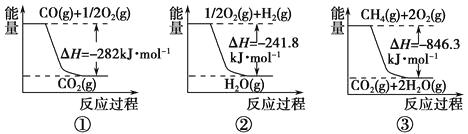
反应①②③均为____________反应(填“吸热”或“放热”)。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。为进一步提高CO2
CO(NH2)2(l)+H2O(g)。为进一步提高CO2
的平衡转化率,下列措施中能达到目的的是____________。
A.增大NH3的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
(3)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2(g)![]() NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
(NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
①第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低.因此,总反应的反应速率和转化率主要取决于___________.(填“第一步”或“第二步”)
②对于第一步反应,不能判断该反应一定达到化学平衡状态的依据是__________(填字母).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ(NH3)正=2υ(CO2)逆
C.恒容容器中气体的密度不随时间变化而变化
D.容器中各物质总质量不随时间变化而变化
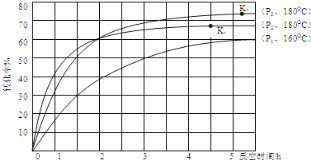
③第一步反应生成了1mol氨基甲酸铵,再发生第二步反应时的转化率与温度、压强的关系如图所示:
在180℃的条件下,P2_________P3(填“>”、“<”或“=”,下同);化学平衡常数K1_________K2.
【答案】(1)放热;(2)AB;(3)①第二步;②AD;③>;=。
【解析】
试题分析:(1)①②③的反应物的总能量大于生成物的总能量,说明反应是放热反应,或者通过△H<0进行判断;(2)提高CO2的转化率,说明平衡向正反应方向进行,A、增大NH3的浓度,增大反应物的浓度,平衡向正反应方向进行,CO2总量不变,转化量增大,CO2的转化率增大,故正确;B、增大压强,平衡向正反应方向移动,CO2的转化率增大,故正确;C、尿素是液态物质,浓度视为常数,对化学平衡无影响,故错误;D、 使用催化剂,对化学平衡无影响,故错误;(3)①总反应速率好转化率的主要取决于反应慢的,即第二步;②A、NH2COONH4是液体,NH3和CO2的平均分子量始终不变,因此不能判断是否达到平衡,故正确;B、用不同种物质的化学反应速率,判断达到平衡,要求化学反应方向一正一逆,且化学反应速率之比等于化学计量数之比,v(NH3)正,说明反应向正反应方向进行,v(CO2)逆说明反应向逆反应方向进行,且两者速率之比等于化学计量数之比,能够判断达到平衡,故错误;C、NH2COONH4是液体,这是在恒压下测定,NH3和CO2的质量减小与它们的物质的量增加的量比例相等,因此密度不变,不能作为达到平衡的标志,故正确;D、当各物质的质量不再改变,说明反应达到平衡,故错误;③压强越大,化学反应速率越快,达到平衡的时间越短,即P2>P3,化学平衡常数只受温度的影响,不随压强的变化而变化,因此K1=K2。

 名校课堂系列答案
名校课堂系列答案