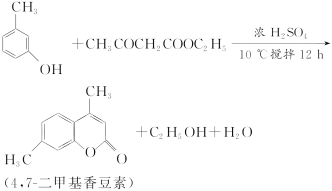
题目内容
【题目】为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是( )
A. NaOH B. MgO C. 氨水 D. Na2CO3
【答案】B
【解析】试题分析:FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末、MgO或MgCO3,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,故选B。

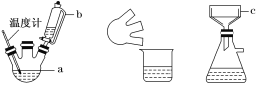
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
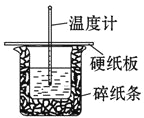
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).