题目内容
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
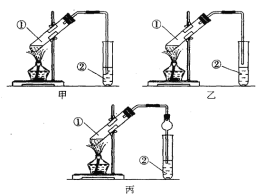
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 (选填 “甲”或 “乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是 。
【问题讨论】
a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:
无色油状液体、 、 ;
b.试管②中饱和 Na2CO3 溶液的作用是 (填编号)。
A.溶解乙醇 B.降低乙酸乙酯的溶解度 C.中和乙酸
c.从试管②中分离出乙酸乙酯的实验操作是 。
d.生成乙酸乙酯的化学反应方程式 。
f.乙醇在铜或银作催化剂时,可以被氧化为一种有刺激性气味的物质,写出该反应的化学反应方程式 。
【答案】乙,防止倒吸;a.不溶于水、有水果香味或密度比水小;b.ABC;c.分液;
d.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;e.2C2H5OH+O2
CH3COOC2H5+H2O;e.2C2H5OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
【解析】
试题分析:为防止倒吸,导管不能伸入液面以下,因此实验室制备乙酸乙酯,应选用乙装置,乙酸乙酯中混有乙酸和乙醇,乙酸和乙醇易溶于水,因此球形干燥管作用是防止倒吸,乙酸乙酯常温常压下是液体,从试管中出来的是气体,因此干燥管的另一个作用是冷凝作用;a、乙酸乙酯不溶于水的油状液体,密度小于水的密度,有香味;b、碳酸钠的作用是吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度使之析出,故选项ABC正确;c、乙酸乙酯不溶于水的液体,两者是互不相溶的液体,应采用分液的方法分离;d、乙酸和乙醇发生酯化反应,其反应方程式为:CH3COOH+ C2H5OH![]() CH3COO C2H5+ H2O ;e、乙醇在铜或银的作用下,乙醇被氧气氧化,即反应方程式为:2C2H5OH + O2
CH3COO C2H5+ H2O ;e、乙醇在铜或银的作用下,乙醇被氧气氧化,即反应方程式为:2C2H5OH + O2![]() 2CH3CHO+2 H2O。
2CH3CHO+2 H2O。