题目内容
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
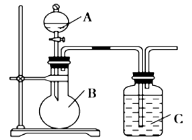
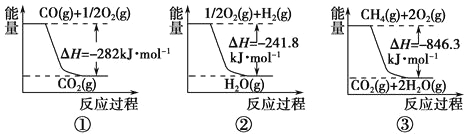
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,强酸一般能制取弱酸。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3。(不考虑硝酸的挥发性)
A、B、C中盛装的试剂分别为____________、____________、____________。C中实验现象为____________________;
写出C中发生反应的离子方程式:____________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用上图装置证明氯气氧化性强于碘单质的氧化性。A中盛装浓盐酸,B中装入高锰酸钾粉末,实验时C中溶液变成蓝色,则:C中盛装的试剂为_________________;写出C中离子方程式_____________________。该实验该装置有明显不足,请指出改进方法:__________________________。
(3)如果C中盛装饱和氢硫酸(H2S饱和水溶液),A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀。写出该反应的化学方程式:_____________;如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2 (填序号)。
A.漂白性 B.氧化性 C.还原性 D.酸性
【答案】(1)硝酸溶液 碳酸钙 硅酸钠溶液 产生白色沉淀(各1分)
CO2+SiO32-+H2O=H2SiO3↓+CO32-或CO2+SiO32-+H2O=H2SiO3(胶体)+CO32-
或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-(2分)
(2)KI淀粉溶液(1分) 2I-+Cl2=I2+2Cl-(2分)
增加装有NaOH溶液的尾气吸收装置(2分)
(3)Cl2+H2S=S↓+2HCl(2分) B(2分)
【解析】
试题分析:(1)根据较强的酸制取较弱的酸可知,A中装试剂是硝酸溶液,B中装试剂是碳酸钙,C中装试剂硅酸钠溶液。由于碳酸的酸性强于硅酸的,所以C中有白色沉淀硅酸生成,反应的方程式是CO2+SiO32-+H2O=H2SiO3↓+CO32-。
(2)酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以C中试剂是淀粉碘化钾溶液。由于氯气能把碘化钾氧化生成单质碘,所以实验现象是溶液变蓝色,反应的离子方程式是2I-+Cl2=I2+2Cl-;由于氯气有毒,所以必须增加装有氢氧化钠溶液的尾气吸收装置。
(3)高锰酸钾溶液能把盐酸氧化生成氯气,而氯气能把硫化氢氧化生成单质S沉淀,所以反应的方程式是Cl2+H2S=S↓+2HCl,这说明氯的非金属性比硫的非金属性强。如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2得到电子,体现氧化性,答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
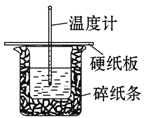
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).
【题目】下列对晶体类型判断正确的是( )
选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
A. A B. B C. C D. D