题目内容
已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为_______
(2)所得溶液中Cl-的物质的量为________mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=______________。
(6分)
(1)10.7% (2分)(2)0.25 (2分) (3)3:2 (2分)
解析试题分析:由题意知,n(NaOH)="3.00" mol·L-1×100×10-3 L="0.300" mol
(1)NaOH溶液的质量分数为: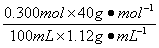 ×100%=10.7%
×100%=10.7%
(2)所得溶液中含有NaCl和NaClO,根据Na+守恒可得:n(Na+)=n(Cl-)+n(ClO-),所以
n(Cl-)=n(Na+)-n(ClO-)="0.300" mol-0.050 0 mol="0.250" mol
(3)NaClO物质的量为0.0500mol,则Cl2 + 2NaOH =" NaCl" + NaClO + H2O
0.0500mol 0.100mol 0.0500mol
所以与HCl反应的NaOH为:0.300mol-0.100mol=0.200mol
HCl + NaOH = NaCl + H2O
0.200mol 0.200mol
H2与Cl2反应生成HCl H2 + Cl2  2HCl
2HCl
0.100 mol 0.100 mol 0.200 mol
所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)="(0.100" mol+0.050 0 mol):0.100 mol=3:2
考点:本题考查溶质的质量分数与物质的量浓度的换算、元素守恒、化学方程式的计算。

某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的两种或多种。取该溶液100mL,加入过量NaOH溶液,加热,得到448mL(标况)气体,同时产生红褐色沉淀,经过滤、洗涤、灼烧,得到1.6g固体;将上述滤液平均分成两份,一份中加足量BaCl2溶液,得到2.33g不溶于盐酸的沉淀;另一份中通入过量CO2得到1.56g白色沉淀。由此可推断原溶液一定含有的离子种类及其浓度,将结果填入下表(可不填满)。
| 一定含有的离子种类 | | | | | | | |
| 物质的量浓度(mol/L) | | | | | | | |
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③数据可靠。通过计算,分析和比较上表3组数据,给出结论。
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
(2)每一等份的混合物粉末中铜的质量。