题目内容
一定量的氧化铜被足量的一氧化碳在加热的情况下还原,得到的气体通入含有X摩氢氧化钙的澄清石灰水,得沉淀Y克,则原氧化铜的质量是多少?
[已知反应CaC03 + CO2 + H20→Ca(HCO3)2 ]
(80Y/100)g(200X-Y/100)×80g
解析试题分析:反应分两种情况情况:
Ca(OH)2过量发生反应如下:Ca(OH)2 + CO2 ="=" CaC03 ↓+H20 CuO + CO  Cu + CO2
Cu + CO2
44g 100g 80 44g
m(CO2) Yg m(CuO)(44Y/100)g
求得 m(CO2)=(44Y/100)g m(CuO)=(80Y/100)g
CO2过量发生反应如下:CaC03 + CO2 + H20==Ca(HCO3)2 Ca(OH)2 + CO2 ="=" CaC03 ↓+H2O
100g 44g 1mol 1mol
100Xg-Yg m1(CO2) Xmol m2(CO2) Xmol
CuO + CO  Cu + CO2
Cu + CO2
求得m1(CO2)=44g×(100Xg-Yg)÷100g m2(CO2)=44Xg 则CuO的质量为(200X-Y/100)×80g
考点:化学计算

练习册系列答案
相关题目
下图是硫酸试剂瓶标签上的内容。
| 硫酸:化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g·cm-3 质量分数:98% |
(2)实验室用该硫酸配制240mL 0.46mol/L的稀硫酸,则
①有以下仪器: A.烧杯 B.100mL量筒 C.250mL容量瓶 D.500mL容量瓶 E.玻璃棒 F.托盘天平(带砝码)G.10mL量筒H.胶头滴管,配制时,必须使用的仪器有 (填代号).
②需要该硫酸的体积为 mL.
③下图为配制过程中的几个关键步骤和操作:将上述实验步骤A—F按实验过程
先后次序排列 。
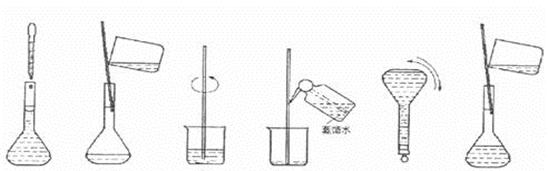
|
④该同学实际配制得到的浓度为0.45mol/L,可能的原因是
A.量取浓H2SO4时仰视刻度
B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶
D.定容时仰视刻度
 NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求: 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3