题目内容
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol·L-1NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:混合液中H2SO4、HNO3的物质的量浓度各是多少?
(1)c(H2SO4)=4.0mol·L-1 c(HNO3)=6.0mol·L-1
解析试题分析:加入足量BaCl2溶液,溶液中因生成的是BaSO4沉淀。n(BaSO4)=9.32g÷233g/mol=0.04mol 。所以可以利用守恒推出n(H2SO4)=n(BaSO4)=0.04mol 。再利用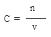 ,则c(H2SO4)=0.04mol÷0.01L=4.0mol·L-1
,则c(H2SO4)=0.04mol÷0.01L=4.0mol·L-1
又因为H++OH-=H2O ,n(OH-)=CV=4.0mol·L-1*0.035L=0.14mol,可以知道n (H+)=0.14mol,,因为n(H2SO4)=0.04mol,所以硫酸中H+的物质的量为。结合刚才求出的溶液中H+的总量为0.14mol,可以推出HNO3中H+=0.14 mol-0.08mol=0.06mol。最后C(HNO3)=0.06mol÷0.01L=6.0mol·L-1。
考点:要求学生具体掌握物质的量的基本计算。以及运用原子守恒来进行量的分析。

某厂平均每天产生约600 m3废氨水(NH3的浓度为153 mg·L-1,密度为1 g·cm—3。
(1)该废氨水中氨的物质的量浓度为 。
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3 的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为 。(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2 →2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量。
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
试计算生成氨气的质量最大时样品的质量。
实验室要用98%(密度为1.84g.cm-3)的硫酸配制3.68mol/L的硫酸溶液480mL。
(1)需准确量取98%的硫酸 mL。
(2)要配制3.68mol/L的硫酸溶液480mL,必须用到的仪器是烧杯、玻璃棒、量筒
(3)若配制3.68mol/L的硫酸溶液的其它操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是 。
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 |
| D.用胶头滴管向容量瓶中加水时,仰视观察溶液凹液面与容量瓶刻度相切 |
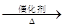 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3