题目内容
【题目】已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[ ![]() ]时CH4的平衡转化率如图所示.下列说法正确的是( )
]时CH4的平衡转化率如图所示.下列说法正确的是( ) 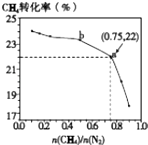
A.![]() 越大,CH4的转化率越高
越大,CH4的转化率越高
B.![]() 不变时,若升温,NH3的体积分数会增大
不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
【答案】B
【解析】解:A.由图象看出,CH4的转化率随着 ![]() 的增大而降低,故A错误;
的增大而降低,故A错误;
B.△H>0,该反应是吸热反应,升高温度平衡正向移动,NH3的体积分数会增大,故B正确;
C.ab两点的温度相同,平衡常数只与温度有关,则平衡常数不变,故C错误;
D.a点甲烷转化率为22%, ![]() =0.75,则设甲烷为3mol,氮气为4mol,
=0.75,则设甲烷为3mol,氮气为4mol,
3CH4(g)+ | 2N2(g) |
| 3C(s)+ | 4NH3(g) | △H>0 | |
开始 | 3 | 4 | 0 | |||
转化 | 0.66 | 0.44 | 0.88 | |||
平衡 | 2.34 | 3.56 | 0.88 |
则NH3的体积分数约为 ![]() ×100%=13%,故D错误;
×100%=13%,故D错误;
故选B.

【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W元素在周期表中的位置
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为<<<(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性> .
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 .
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 .
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 