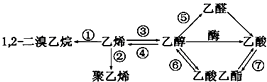
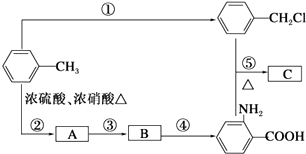
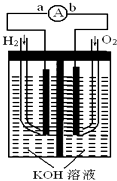
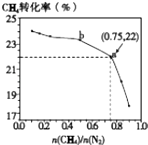
��Ŀ����
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ����ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��WԪ�������ڱ��е�λ��
��2��X��Y��Z��W�ֱ��γɵļ����ӵİ뾶��С�����˳��Ϊ���������û�ѧʽ��д����ͬ����Y��Z��Ӧ����̬�⻯����ȶ����� ��
��3����һ�������£���Ԫ��Y��Z��ɵ�һ����̬������ɷ�����������Ӧ����Ӧ��ƽ��ʱ��������̬���ʹ��棬��֪ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��4����ҵ�Ͻ������W����ͨ�����ڵ�Z�����п��Ƶû�����Z2W2 �� �����ʿ���ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬д��Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1���������ڵ�VIIA��
��2��O2����N3����Cl����S2����H2O��H2S
��3��2SO2��g��+O2��g��?2SO3��g����H=��190.0kJ?mol��1
��4��2S2Cl2+2H2O=SO2+3S+4HCl
���������⣺��1��WΪClԪ�أ��������ڱ��е������ڵ�VIIA �壬���Դ��ǣ��������ڵ�VIIA �壻��2����������Ų���ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�������Ӻ�����Ӳ���Խ�࣬���Ӱ뾶Խ���������Ӱ뾶O2����N3����Cl����S2�� �� �ǽ�����Խǿ����̬�⻯����ȶ���Խǿ�����ڷǽ����ԣ�O��S��������̬�⻯����ȶ��ԣ�H2O��H2S�����Դ��ǣ�O2����N3����Cl����S2����H2O��H2S����3����һ�������£�������Q��Y�ĵ��ʷ�Ӧ��ƽ��ʱ��������̬���ʣ���Ӧ����ʽΪ��2SO2+O22SO3 �� ��Ӧʱ��ÿת��4mol���ӷ���190.0kJ����μӷ�Ӧ��������Ϊ ![]() =2mol���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2SO2 ��g��+O2��g��2SO3��g����H=��190.0 kJmol��1 ��
=2mol���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2SO2 ��g��+O2��g��2SO3��g����H=��190.0 kJmol��1 ��
���Դ��ǣ�2SO2��g��+O2��g��2SO3��g����H=��190.0 kJmol��1����4��������S2Cl2����ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬������ΪSO2 �� 0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬��SԪ�ػ��ϼ۽��ͣ�ת��0.3mol�������ɶ�������Ϊ0.1mol������0.3molSԭ�ӷ�����ԭ��Ӧ�����ݵ���ת���غ��֪SԪ���ڻ�ԭ�����еĻ��ϼ�Ϊ0��������S��ͬʱ����HCl���÷�Ӧ�Ļ�ѧ����ʽΪ��2S2Cl2+2H2O�T3S��+SO2��+4HCl��
���Դ��ǣ�2S2Cl2+2H2O=SO2+3S+4HCl��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�