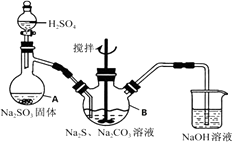
ĢāÄæÄŚČŻ
”¾ĢāÄæ”æĆ¾¼°Ęä»ÆŗĻĪļÓĆĶ¾·Ē³£¹ć·ŗ£¬ÄæĒ°ŹĄ½ēÉĻ60%µÄĆ¾ŹĒ“Óŗ£Ė®ÖŠĢįČ”£®“Óŗ£Ė®ÖŠĻČ½«ŗ£Ė®µ»Æ»ńµĆµĖ®ŗĶÅØŗ£Ė®£¬ÅØŗ£Ė®µÄÖ÷ŅŖ³É·ÖČēĻĀ£ŗ
Ąė×Ó | Na+ | Mg2+ | Cl© | SO42© |
ÅضČ/£ØgL©1£© | 63.7 | 28.8 | 144.6 | 46.4 |
ŌŁĄūÓĆÅØŗ£Ė®ĢįĆ¾µÄŅ»¶Ī¹¤ŅÕĮ÷³ĢČēĻĀĶ¼£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā
£Ø1£©ÅØŗ£Ė®Ö÷ŅŖŗ¬ÓŠµÄĖÄÖÖĄė×ÓÖŠĪļÖŹµÄĮæÅضČ×īŠ”µÄŹĒ £® ŌŚÉĻŹöĮ÷³ĢÖŠ£¬æÉŅŌŃ»·Ź¹ÓƵÄĪļÖŹŹĒ £®
£Ø2£©ŌŚøĆ¹¤ŅÕ¹ż³ĢÖŠ£¬XŹŌ¼ĮµÄ»ÆѧŹ½ĪŖ £®
£Ø3£©”°Ņ»¶ĪĶŃĖ®”±ÄæµÄŹĒÖʱøMgCl22H2O£»”°¶ž¶ĪĶŃĖ®”±µÄÄæµÄŹĒÖʱøµē½āŌĮĻ£®Čō½«MgCl26H2OÖ±½Ó¼ÓČČĶŃĖ®£¬Ōņ»įÉś³ÉMg£ØOH£©Cl£®Čōµē½āŌĮĻÖŠŗ¬ÓŠMg£ØOH£©Cl£¬µē½āŹ±Mg£ØOH£©ClÓėŅõ¼«²śÉśµÄMg·“Ó¦£¬Ź¹Ņõ¼«±ķĆę²śÉśMgO¶Ū»ÆĤ£¬½µµĶµē½āŠ§ĀŹ£®Éś³ÉMgOµÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø4£©ČōÖʵĆMg£ØOH£©2µÄ¹ż³ĢÖŠÅØŗ£Ė®µÄĄūÓĆĀŹĪŖ80%£¬ÓÉMg£ØOH£©2ÖĮ”°¶ž¶ĪĶŃĖ®”±ÖʵƵē½āŌĮĻµÄ¹ż³ĢÖŠĆ¾ŌŖĖŲµÄĄūÓĆĀŹĪŖ90%£¬Ōņ1m3ÅØŗ£Ė®æɵƔ°¶ž¶ĪĶŃĖ®”±ŗóµÄµē½āŌĮĻÖŹĮæĪŖg£®
£Ø5£©ŅŌLiCl©KCl¹²ČŪŃĪĪŖµē½āÖŹµÄMg©V2O5µē³ŲŹĒÕ½Źõµ¼µÆµÄ³£ÓƵēŌ“£¬øƵē³ŲµÄ×Ü·“Ó¦ĪŖ£ŗMg+V2O5+2LiCl MgCl2+V2O4Li2O øƵē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖ £®
£Ø6£©MgŗĻ½šŹĒÖŲŅŖµÄ“¢Ēā²ÄĮĻ£®2LiBH4/MgH2ĢåĻµ·ÅĒāģŹ±äŹ¾ŅāĶ¼ČēĻĀ£¬Ōņ£ŗ Mg£Øs£©+2B£Øs£© MgB2£Øs£©”÷H= £® 
”¾“š°ø”æ
£Ø1£©SO42©£»Cl2”¢HCl
£Ø2£©CaCl2
£Ø3£©2Mg£ØOH£©Cl+Mg=MgCl2+2MgO+H2”ü
£Ø4£©82080
£Ø5£©V2O5+2Li++2e©=V2O4?Li2O
£Ø6£©©93kJ/mol
”¾½āĪö”æ½ā£ŗÅØŗ£Ė®¼ÓČėĀČ»ÆøĘ£¬æÉÉś³ÉĮņĖįøĘ£¬Ņ»“ļµ½ĶŃĮņµÄÄæµÄ£¬¼ÓČėŹģŹÆ»Ņ£¬æÉÉś³ÉĒāŃõ»ÆĆ¾£¬½ų¶ųÉś³ÉMgCl26H2O£¬Ņ»¶ĪĶŃĖ®Éś³ÉMgCl22H2O£¬ŌŚĶØČėHClµÄ·ÕĪ§ÖŠ¼ÓČėĀČ»ÆĆ¾ČÜŅŗµĆµ½ĀČ»ÆĆ¾£¬µē½āæɵƵ½Ć¾ŗĶĀČĘų£¬£Ø1£©ÓɱķÖŠŹż¾Żc£ØNa+£©= ![]() =2.77mol/L£¬c£ØMg2+£©=
=2.77mol/L£¬c£ØMg2+£©= ![]() =1.2mol/L£¬c£ØCl©£©=
=1.2mol/L£¬c£ØCl©£©= ![]() =4.07mol/L£¬c£ØSO42©£©=
=4.07mol/L£¬c£ØSO42©£©= ![]() =0.48mol/L£¬¹ŹSO42©µÄĪļÖŹµÄĮæÅضČ×īŠ”£¬ÉĻŹöĮ÷³ĢÖŠĀČĘųŗĶÓėĒāĘų·“Ӧɜ³ÉĀČ»ÆĒā£¬ĀČ»ÆĒāæÉÓėĒāŃõ»ÆĆ¾·“Ó¦ÖʱøĀČ»ÆĆ¾£¬ŌņæÉŃ»·µÄŹĒCl2”¢HCl£¬ĖłŅŌ“š°øŹĒ£ŗSO42©£»Cl2”¢HCl£»£Ø2£©XĪŖĀČ»ÆøĘ£¬æÉÉś³ÉĮņĖįøĘ£¬Ņ»“ļµ½ĶŃĮņµÄÄæµÄ£¬ĖłŅŌ“š°øŹĒ£ŗCaCl2£»£Ø3£©ÓÉĢāŅāÖŖMg£ØOH£©ClÓėŅõ¼«²śÉśµÄMg·“Ó¦£¬²śÉśMgO£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2Mg£ØOH£©Cl+Mg=MgCl2+2MgO+H2”ü£¬ĖłŅŌ“š°øŹĒ£ŗ2Mg£ØOH£©Cl+Mg=MgCl2+2MgO+H2”ü£»£Ø4£©ÓÉĢāøųŹż¾ŻæÉÖŖ1m3ÅØŗ£Ė®ŗ¬ÓŠm£ØMg2+£©=1000L”Į28.8g/L£¬n£ØMg2+£©=
=0.48mol/L£¬¹ŹSO42©µÄĪļÖŹµÄĮæÅضČ×īŠ”£¬ÉĻŹöĮ÷³ĢÖŠĀČĘųŗĶÓėĒāĘų·“Ӧɜ³ÉĀČ»ÆĒā£¬ĀČ»ÆĒāæÉÓėĒāŃõ»ÆĆ¾·“Ó¦ÖʱøĀČ»ÆĆ¾£¬ŌņæÉŃ»·µÄŹĒCl2”¢HCl£¬ĖłŅŌ“š°øŹĒ£ŗSO42©£»Cl2”¢HCl£»£Ø2£©XĪŖĀČ»ÆøĘ£¬æÉÉś³ÉĮņĖįøĘ£¬Ņ»“ļµ½ĶŃĮņµÄÄæµÄ£¬ĖłŅŌ“š°øŹĒ£ŗCaCl2£»£Ø3£©ÓÉĢāŅāÖŖMg£ØOH£©ClÓėŅõ¼«²śÉśµÄMg·“Ó¦£¬²śÉśMgO£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2Mg£ØOH£©Cl+Mg=MgCl2+2MgO+H2”ü£¬ĖłŅŌ“š°øŹĒ£ŗ2Mg£ØOH£©Cl+Mg=MgCl2+2MgO+H2”ü£»£Ø4£©ÓÉĢāøųŹż¾ŻæÉÖŖ1m3ÅØŗ£Ė®ŗ¬ÓŠm£ØMg2+£©=1000L”Į28.8g/L£¬n£ØMg2+£©= ![]() mol£¬ŌņÉś³ÉMg£ØOH£©2µÄĪļÖŹµÄĮæĪŖ
mol£¬ŌņÉś³ÉMg£ØOH£©2µÄĪļÖŹµÄĮæĪŖ ![]() mol”Į80%£¬¾¶ž¶ĪĶŃĖ®Éś³ÉMgCl2µÄĪļÖŹµÄĮæĪŖ
mol”Į80%£¬¾¶ž¶ĪĶŃĖ®Éś³ÉMgCl2µÄĪļÖŹµÄĮæĪŖ ![]() ”Į80%”Į90%£¬ÖŹĮæĪŖ
”Į80%”Į90%£¬ÖŹĮæĪŖ ![]() mol”Į80%”Į90%”Į95g/mol=82080g£¬ĖłŅŌ“š°øŹĒ£ŗ82080£»£Ø5£©Õż¼«·¢Éś»¹Ō·“Ó¦£¬V2O5±»»¹ŌÉś³ÉV2O4Li2O£¬µē¼«·½³ĢŹ½ĪŖV2O5+2Li++2e©=V2O4Li2O£¬ĖłŅŌ“š°øŹĒ£ŗV2O5+2Li++2e©=V2O4Li2O£»£Ø6£©ÓÉĶ¼æÉÖŖ£ŗ2LiBH4£Øs£©+MgH2£Øs£©=2LiH£Øs£©+2B£Øs£©+MgH2£Øs£©+3H2£Øg£©”÷H=+200 kJmol©1¢Ł 2LiBH4£Øs£©+MgH2£Øs£©=2LiBH4£Øs£©+Mg£Øs£©£©+H2£Øg£©”÷H=+76 kJmol©1¢Ś
mol”Į80%”Į90%”Į95g/mol=82080g£¬ĖłŅŌ“š°øŹĒ£ŗ82080£»£Ø5£©Õż¼«·¢Éś»¹Ō·“Ó¦£¬V2O5±»»¹ŌÉś³ÉV2O4Li2O£¬µē¼«·½³ĢŹ½ĪŖV2O5+2Li++2e©=V2O4Li2O£¬ĖłŅŌ“š°øŹĒ£ŗV2O5+2Li++2e©=V2O4Li2O£»£Ø6£©ÓÉĶ¼æÉÖŖ£ŗ2LiBH4£Øs£©+MgH2£Øs£©=2LiH£Øs£©+2B£Øs£©+MgH2£Øs£©+3H2£Øg£©”÷H=+200 kJmol©1¢Ł 2LiBH4£Øs£©+MgH2£Øs£©=2LiBH4£Øs£©+Mg£Øs£©£©+H2£Øg£©”÷H=+76 kJmol©1¢Ś
2LiBH4£Øs£©+MgH2£Øs£©=2LiH£Øs£©+MgB2£Øs£©+4H2£Øg£©”÷H=+183 kJmol©1¢Ū
2LiH£Øs£©+MgB2£Øs£©+4H2£Øg£©=2LiH£Øs£©+2B£Øs£©+MgH2£Øs£©+3H2£Øg£©”÷H=+£Ø200©183£©kJmol©1¢Ü
¼“£ŗMgB2£Øs£©+H2£Øg£©=2B£Øs£©+MgH2£Øs£©”÷H=+17 kJmol©1¢Ü
ĖłŅŌ©¢Ü©¢ŚµĆ£ŗMg£Øs£©+2B£Øs£©ØTMgB2£Øs£©”÷H=©£Ø17+76£©kJmol©1=©93kJmol©1 £¬
ĖłŅŌ“š°øŹĒ£ŗ©93kJmol©1 £®
”¾æ¼µć¾«Īö”æ¹ŲÓŚ±¾Ģāæ¼²éµÄ·“Ó¦ČČŗĶģŹ±ä£¬ŠčŅŖĮĖ½āŌŚ»Æѧ·“Ó¦ÖŠ·Å³ö»ņĪüŹÕµÄČČĮ棬Ķس£½Š·“Ó¦ČČ²ÅÄÜµĆ³öÕżČ·“š°ø£®