题目内容
12.描述或解释下列现象的离子方程式,不正确的是( )| A. | 碳酸氢铵溶液中加足量石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O | |
| B. | 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O | |
| C. | 滴有石蕊的烧碱溶液里通CO2至颜色变红:CO2+2OH-=CO32-+H2O | |
| D. | 漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
分析 A.石灰水过量反应生成碳酸钙、一水合氨和水;
B.碳酸氢钠溶液与硫酸氢钠溶液反应反应生成二氧化碳、硫酸钠和水;
C.石蕊溶液变红,说明溶液显示酸性,二氧化碳过量,氢氧根离子与二氧化碳反应生成碳酸氢根离子;
D.次氯酸根离子与氢氧根离子发生双水解生成氢氧化铁和次氯酸.
解答 解:A.碳酸氢铵溶液中加足量石灰水,离子方程式:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O,故A正确;
B.碳酸氢钠溶液与硫酸氢钠溶液反应,离子方程式:HCO3-+H+=CO2↑+H2O,故B正确;
C.滴有蓝色石蕊的烧碱溶液里通CO2至颜色变红,说明二氧化碳过量,反应生成碳酸氢根离子,反应的离子方程式为:CO2+OH-═HCO3-,故C错误;
D.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO,故D正确.
故选:C.
点评 本题考查了离子方程式的书写,明确指示剂变色范围是解题关键,题目不难.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
20.已知化学式为C12H12的物质其结构简式为  ,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )
,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )
 ,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )
,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )| A. | 4种 | B. | 9种 | C. | 12种 | D. | 6种 |
7.已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2( g )+3H2( g )=2NH3( g )1molN2完全消耗共放出能量为92.4kJ,则N≡N键的键能是( )
| A. | 431 KJ/mol | B. | 946 KJ/mol | C. | 649 KJ/mol | D. | 869 KJ/mol |
17.下列叙述中正确的是( )
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜是负极 | |
| C. | 铜铁原电池工作时,若有2.8 g铁被溶解,电路中就有0.15mol电子通过 | |
| D. | 由镁、铝作电极与NaOH溶液构成的原电池中铝是负极 |
4.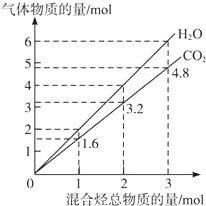 两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( )
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷 ⑤可能有乙烷 ⑥可能有乙炔.
 两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( ) ①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷 ⑤可能有乙烷 ⑥可能有乙炔.
| A. | ②⑤⑥ | B. | ②⑥ | C. | ②④ | D. | ②③ |
1.仅用蒸馏水,不能鉴别的一组物质是( )
| A. | 苯和四氯化碳 | B. | 溴蒸气和二氧化氮 | ||
| C. | 碘和高锰酸钾 | D. | 葡萄糖和蔗糖 |
 NH3
NH3 NH4Cl
NH4Cl K2S
K2S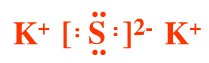 NaOH
NaOH
 ;CaF2
;CaF2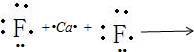
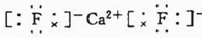 .
. X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:
X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题: