题目内容
7.已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2( g )+3H2( g )=2NH3( g )1molN2完全消耗共放出能量为92.4kJ,则N≡N键的键能是( )| A. | 431 KJ/mol | B. | 946 KJ/mol | C. | 649 KJ/mol | D. | 869 KJ/mol |
分析 根据反应热△H=反应物的总键能-生成物的总键能,以此解答.
解答 解:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热△H=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=946 kJ/mol,
故选:B.
点评 本题考查反应热的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,掌握反应热与键能的关系是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.SO2有毒,但葡萄酒里都含有SO2,起保鲜、杀菌和抗氧化作用.下列说法不正确的是( )
| A. | 葡萄酒中的SO2对人体无害,是因为它的含量很少 | |
| B. | 葡萄酒中的SO2具有抗氧化作用,是因为它具有较强的还原性 | |
| C. | 从红葡萄酒的颜色判断,其中的SO2没有漂白性 | |
| D. | 葡萄酒倒入酒杯摇一摇,可以减少其中SO2的含量 |
15.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在这些元素中,化学性质最不活泼的元素名称是氖,元素原子半径最小的是H,⑧号元素的离子结构示意图为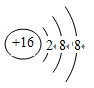 .
.
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)⑧、⑨号元素的氢化物中还原性较强的是H2S(填化学式).
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O
(5)写出能说明⑨的非金属性比⑧强的一个实验事实氯气与硫化钠反应生成氯化钠和硫单质.
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
.(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)⑧、⑨号元素的氢化物中还原性较强的是H2S(填化学式).
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O
(5)写出能说明⑨的非金属性比⑧强的一个实验事实氯气与硫化钠反应生成氯化钠和硫单质.
12.描述或解释下列现象的离子方程式,不正确的是( )
| A. | 碳酸氢铵溶液中加足量石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O | |
| B. | 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O | |
| C. | 滴有石蕊的烧碱溶液里通CO2至颜色变红:CO2+2OH-=CO32-+H2O | |
| D. | 漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
19.下列说法中错误的是( )
| A. | NH4H的电子式为: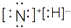 | B. | S2-的离子结构示意图为: | ||
| C. | H2O的形成过程: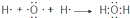 | D. | NaCl的形成过程: |
16.下列说法不正确的是( )
| A. | 互为同系物的有机物,它们的分子结构必然相似 | |
| B. | 互为同分异构体的有机物,它们的分子式必然相同 | |
| C. | 凡相对分子质量相等、各元素的质量分数相等,而结构不同的有机物一定互为同分异构体 | |
| D. | 凡分子组成相差一个或几个原子团的物质一定是同系物 |