题目内容
3. X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:
X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:(1)上述5种元素中,电负性最大的是(填名称)氧,X3Z+的VSEPR模型名称是正四面体.
(2)M基态原子的电子排布式是1s22s22p63s23p63d54s1.
(3)R的单质为面心立方最密堆积(见图),则一个晶胞中R原子数为4,R的配位数是12.
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是Cr2O3+2OH-=2CrO2-+H2O.
分析 X、Y、Z、R均为短周期元素且原子序数依次增大.Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同,原子核外电子排布为1s22s22p2,故Y为C元素;Z 的两种同素异形体都存在于大气中,对生命起着重要作用,则Z为O元素;X、R原子核外电子层数等于其最外层电子数,符合条件的元素有H、Be、Al,原子半径X<Y(C),故X为H元素,R的原子序数大于氧,故R为Al;M元素位于周期表的第4周期第6列,则M为Cr,据此解答.
解答 解:X、Y、Z、R均为短周期元素且原子序数依次增大.Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同,原子核外电子排布为1s22s22p2,故Y为C元素;Z 的两种同素异形体都存在于大气中,对生命起着重要作用,则Z为O元素;X、R原子核外电子层数等于其最外层电子数,符合条件的元素有H、Be、Al,原子半径X<Y(C),故X为H元素,R的原子序数大于氧,故R为Al;M元素位于周期表的第4周期第6列,则M为Cr.
(1)上述5种元素中,O元素非金属性最强,故氧元素电负性最大,H3O+离子中O原子价层电子对数为3+$\frac{6-1-1×3}{2}$=4,其VSEPR模型为正四面体,
故答案为:氧;正四面体;
(2)M元素位于周期表的第4周期第6列,为Cr元素,基态原子的电子排布式是1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(3)R的单质为面心立方最密堆积,则一个晶胞中R原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,以顶点原子研究,与之最近的原子处于面心,每个顶点R原子为12个面共用,故R的配位数是12,
故答案为:4;12;
(4)Cr2O3与Al2O3结构和性质相似,则Cr2O3溶于强碱时发生反应的离子方程式是:Cr2O3+2OH-=2CrO2-+H2O,故答案为:Cr2O3+2OH-=2CrO2-+H2O.
点评 本题是对物质结构的考查,涉及位置结构性质关系、价层电子对数互斥理论、核外电子排布、晶胞计算等,推断元素是解题关键,注意对基础知识的理解掌握.

| A. | 烷烃分子中,碳原子都以碳碳单键结合,其余的价键均与氢原子结合,这一系列化合物的分子通式为C2nH2n+2 | |
| B. | 分子组成相差一个或若干个CH2原子团的物质,互称为同系物 | |
| C. | 烷烃分子中,相邻的三个碳原子有可能在同一条直线上 | |
| D. |  CH4、CH3CH2CH3互为同系物 CH4、CH3CH2CH3互为同系物 |
| A. | 乙烷 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
| A. | 按系统命名法, 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 | |
| B. | 实验证实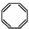 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为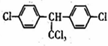 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. | 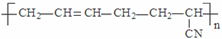 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
| A. | 葡萄酒中的SO2对人体无害,是因为它的含量很少 | |
| B. | 葡萄酒中的SO2具有抗氧化作用,是因为它具有较强的还原性 | |
| C. | 从红葡萄酒的颜色判断,其中的SO2没有漂白性 | |
| D. | 葡萄酒倒入酒杯摇一摇,可以减少其中SO2的含量 |
| A. | 质子数 | B. | 中子数 | C. | 核外电子数 | D. | 质子数和中子数 |
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
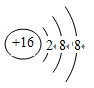 .
.(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)⑧、⑨号元素的氢化物中还原性较强的是H2S(填化学式).
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O
(5)写出能说明⑨的非金属性比⑧强的一个实验事实氯气与硫化钠反应生成氯化钠和硫单质.
| A. | 碳酸氢铵溶液中加足量石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O | |
| B. | 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O | |
| C. | 滴有石蕊的烧碱溶液里通CO2至颜色变红:CO2+2OH-=CO32-+H2O | |
| D. | 漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| 元素 电离能/kJ•mol-1 | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4 562 | 1 451 | 1 817 |
| I3 | 6 912 | 7 733 | 2 754 |
| I4 | 9 540 | 10 540 | 11 578 |
| A. | 三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也最小 | |
| B. | 三种元素中,Y元素的第一电离能最大,其电负性也最大 | |
| C. | 等物质的量的X、Y、Z三种单质与少量盐酸反应时放出的氢气的物质的量之比为1:1:1 | |
| D. | 三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比为3:2:1 |