题目内容
2.(1)请写出以下物质的电子式:CO2
 NH3
NH3 NH4Cl
NH4Cl K2S
K2S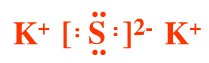 NaOH
NaOH
(2)用电子式表示下列物质的形成过程
H2S
 ;CaF2
;CaF2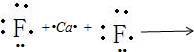
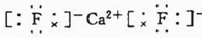 .
.
分析 (1)二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
氨气为共价化合物,分子中存在3个氮氢键,氮原子最外层为8个电子;
氯化铵为离子化合物,钠离子直接用离子符号表示,铵根离子需要标出所带电荷及最外层电子;
硫化钾为离子化合物,必须标出阴阳离子所带电荷,阴离子需要标出最外层电子;
NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合;
(2)NaF是离子化合物,用电子式表示其形成过程时,左边是原子的电子式,右边为氯化钠的电子式;
硫化氢为共价化合物,根据共价化合物的电子式表示方法写出硫化氢的形成过程.
解答 解:(1)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ;
;
NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为 ;
;
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
硫化钾为离子化合物,有钾离子和硫离子构成,其电子式为: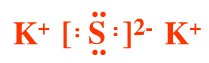 ;
;
NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为 ,
,
故答案为: ;
; ;
; ;
;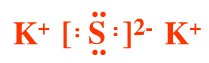 ;
; ;
;
(2)硫化氢为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为: ;
;
氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边,用电子式表示氟化钙的形成过程为: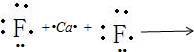
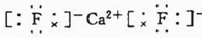 ,
,
故答案为: ;
;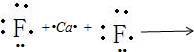
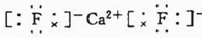 .
.
点评 本题考查了电子式的书写及其应用,题目难度中等,注意电子式的概念及书写方法,明确离子化合物与共价化合物电子式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
12.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | H3O+、NH4+、Cl- | C. | HF、Ne、H2O | D. | NH3、NH4+、F- |
13.下列叙述正确的是( )
| A. | 烷烃分子中,碳原子都以碳碳单键结合,其余的价键均与氢原子结合,这一系列化合物的分子通式为C2nH2n+2 | |
| B. | 分子组成相差一个或若干个CH2原子团的物质,互称为同系物 | |
| C. | 烷烃分子中,相邻的三个碳原子有可能在同一条直线上 | |
| D. | 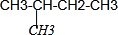 CH4、CH3CH2CH3互为同系物 CH4、CH3CH2CH3互为同系物 |
7.用下列装置制取并收集NO2气体,其中最合理的是( )
| A. | 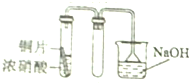 | B. | 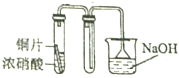 | ||
| C. |  | D. | 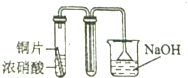 |
14.下列烃中可能存在同分异构体的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
11.下列说法正确的是( )
| A. | 按系统命名法, 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 | |
| B. | 实验证实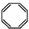 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为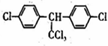 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. |  的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
12.描述或解释下列现象的离子方程式,不正确的是( )
| A. | 碳酸氢铵溶液中加足量石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O | |
| B. | 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O | |
| C. | 滴有石蕊的烧碱溶液里通CO2至颜色变红:CO2+2OH-=CO32-+H2O | |
| D. | 漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |

