题目内容
14.(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置(图1)能达到实验目的是②.(2)将CH4设计成燃料电池,其总利用率比直接燃烧更高,装置如图2所示(A、B为多孔碳棒).
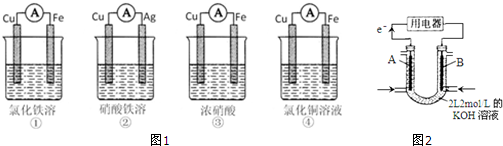
①A(填A或B)处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-
 CO32-+7H2O.
CO32-+7H2O.②当消耗甲烷的体积为22.4L(标准状况下)时,假设化学能全部转化为电能,则导线中转移电子的物质的量为8mol,消耗KOH的物质的量为2mol.
分析 (1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据甲烷和转移电子、氢氧化钾之间的关系式计算.
解答 解:(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐,
①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,故正确;
③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;
④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
故选②;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:A;CH4-8e-+10OH-═CO32-+7H2O;
②甲烷的物质的量为1mol,导线中转移电子的物质的量=1mol×8=8mol,根据CH4-8e-+10OH-═CO32-+7H2O知,消耗KOH的物质的量为甲烷物质的量的2倍,所以消耗氢氧化钾的物质的量是2mol,
故答案为:8mol;2mol.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定氧化性强弱,根据方程式中各个物理量之间的关系式进行计算,题目难度不大.

| A. | $\frac{a}{4b}$mol-1 | B. | $\frac{b}{4a}$mol-1 | C. | $\frac{a}{4b}$ | D. | $\frac{b}{4a}$ |
| A. | NO2 | B. | NO | C. | N2O | D. | NH4NO3 |
| A. | 同浓度稀溶液pH:碳酸>苯酚>乙酸 | B. | 离子半径:O2->F->Na+>Mg2+ | ||
| C. | 晶体熔点:SiO2>P4>NaCl | D. | 沸点:HF<HCl<HBr |
| A. | 氡气的化学性质活泼,对人体有害 | |
| B. | “锕射气”是氡的同位素原子 | |
| C. | 氡原子有7个电子层,最外层有8个电子 | |
| D. | 氡在常温是固体 |
 的说法正确的是( )
的说法正确的是( )| A. | 该物质为丁烷 | B. | 该物质的分子式为C4H8 | ||
| C. | 该物质为丁烯 | D. | 该物质化学性质与苯相似 |