题目内容
19.我国首创以铝─空气─海水电池为能源的新型海水标志灯. 该灯以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流.只要把灯放入海水中数分钟,就会发出耀眼的白光,其能量比干电池高20─50倍(海水呈弱碱性),请回答:该电源负极材料是铝,正极主要的反应物质是3O2+6H2O+12e-═12OH-,总反应方程为:4Al+3O2+6H2O=4Al(OH)3.分析 铝、海水电池作为能源的新型海水标志灯,这种新型电池以Al为负极,发生氧化反应,空气中的氧气为正极,发生还原反应,据此回答判断.
解答 解:以铝、海水电池作为能源的新型海水标志灯,Al为负极,发生氧化反应:4Al-12e-=4Al3+,空气中的氧气为正极,正极材料为石墨,该电极上发生还原反应:3O2+6H2O+12e-═12OH-,总的反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:铝;3O2+6H2O+12e-═12OH-;4Al+3O2+6H2O=4Al(OH)3.
点评 本题考查原电池原理、离子反应方程式的书写,明确原电池正负极的判断方法及各个电极上发生的反应、离子方程式书写规则即可解答,题目难度不大.

练习册系列答案
相关题目
18.NA代表阿伏伽德罗常数,下列说法不正确的是( )
| A. | 1mol Ne含有的电子数目为10NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 2.8g氮气所含的分子数为NA | |
| D. | 1.8gNH4+中含有的质子数为NA |
7.某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿佛加德罗常数,下列说法中不正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1 mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g该氧原子的中子数一定为$\frac{8y}{a}$ |
4.下列有关实验装置的说法中正确的是( )
| A. |  除去氯气中的氯化氢 | B. |  向容量瓶中转移溶液 | ||
| C. | 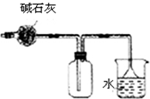 干燥并收集氨气 | D. |  保存浓硝酸 |
11.下列物质同分异构体数目最少的是( )
| A. | C5H10 | B. | C5H12O | C. | C5H11Br | D. | C5H12 |
8.2014年10月27日报道:德国、加拿大和我国复旦大学、清华大学的科学家合作成功制得了IrO4+(其结构如图).已知Ir(铱)与Fe同族且基态原子有6个电子层,则下列关于Ir及其化合物的说法错误的是( )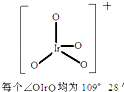

| A. | Ir元素是第六周期第Ⅷ族的金属元素 | |
| B. | IrO4+中Ir的氧化数(即化合价)为+9价 | |
| C. | 在[Ir(CO)3]3-中存在极性键 | |
| D. | IrO4失去1个e-生成IrO4+,发生还原反应 |
9.下列实验方法正确的是( )
| A. | 某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该溶液中一定含有CO32- | |
| B. | 除去HNO3溶液中的少量H2SO4,可加适量BaCl2溶液 | |
| C. | 利用焰色反应可以将NaCl和KCl两种无色溶液鉴别出来 | |
| D. | 某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+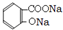 .
.
 CO32-+7H2O.
CO32-+7H2O.