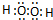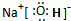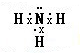题目内容
3.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸馏、③萃取、④加热分解等.下列各组混和物的分离或提纯应采用什么方法?(填序号)(1)提取碘水中的碘③.
(2)除去食盐中的沙子①.
(3)淡化海水②.
(4)KCl中含有KClO3④.
分析 (1)碘不易溶于水,易溶于有机溶剂;
(2)沙子不溶于水,食盐溶于水;
(3)海水中水的沸点较低;
(4)氯酸钾分解生成KCl.
解答 解:(1)碘不易溶于水,易溶于有机溶剂,则选有机溶剂萃取碘水中的碘,故答案为:③;
(2)沙子不溶于水,食盐溶于水,则选择过滤法除去食盐中的沙子,故答案为:①;
(3)海水中水的沸点较低,则选择蒸馏法淡化海水,故答案为:②;
(4)氯酸钾分解生成KCl,则加热分解除杂,故答案为:④.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离提纯为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
11.下列物质同分异构体数目最少的是( )
| A. | C5H10 | B. | C5H12O | C. | C5H11Br | D. | C5H12 |
18.在下列化学反应中,不属于离子反应的是( )
| A. | 锌片投入到稀硫酸中 | B. | H2与O2点燃生成H2O | ||
| C. | 向澄清的石灰水中加入Na2CO3溶液 | D. | 向稀盐酸中滴加KOH溶液 |
8.2014年10月27日报道:德国、加拿大和我国复旦大学、清华大学的科学家合作成功制得了IrO4+(其结构如图).已知Ir(铱)与Fe同族且基态原子有6个电子层,则下列关于Ir及其化合物的说法错误的是( )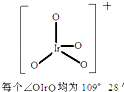

| A. | Ir元素是第六周期第Ⅷ族的金属元素 | |
| B. | IrO4+中Ir的氧化数(即化合价)为+9价 | |
| C. | 在[Ir(CO)3]3-中存在极性键 | |
| D. | IrO4失去1个e-生成IrO4+,发生还原反应 |
15.具备基本的化学实验技能是进行科学探究的基本保证.下列实验操作中正确的是( )
| A. |  称取食盐 | B. |  稀释浓硫酸 | C. |  检测气密性 | D. |  点燃酒精灯 |
13.构建和谐社会的总要求之一是人与自然和谐相处,下列做法不符合这一主题的是( )
| A. | 中科院广州化学所在利用二氧化碳制取可降解塑料的技术方面处于世界领先水平,该技术的成功应用将有效改善以二氧化碳为主的温室气体引发的“厄尔尼诺”、“拉尼娜”等全球气候异常现象 | |
| B. | 许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理,达到消除“白色污染”的目的 | |
| C. | 山东单县采用以杂草、秸秆等为原料的生物质发电,有效地减少了二氧化硫的排放 | |
| D. | 汽油中掺入酒精使用,可以降低对环境的污染和节约能源 |

 CO32-+7H2O.
CO32-+7H2O. ,C元素在周期表中的位置第三周期ⅥA族.
,C元素在周期表中的位置第三周期ⅥA族. 或
或