题目内容
9.下列叙述正确的是( )| A. | 同浓度稀溶液pH:碳酸>苯酚>乙酸 | B. | 离子半径:O2->F->Na+>Mg2+ | ||
| C. | 晶体熔点:SiO2>P4>NaCl | D. | 沸点:HF<HCl<HBr |
分析 A.乙酸与碳酸钠反应生成碳酸,碳酸与苯酚钠反应生成苯酚,均为强酸制取弱酸的反应;
B、电子层结构相同,核电荷数越多半径越小;
C、不同类型的晶体熔点高低:原子晶体>离子晶体>分子晶体;
D、相对分子质量越大,气态氢化物的熔沸点越大,但HF中含有氢键.
解答 解:A.乙酸与碳酸钠反应生成碳酸,碳酸与苯酚钠反应生成苯酚,均为强酸制取弱酸的反应,则酸性为乙酸>碳酸>苯酚,所以同浓度稀溶液pH:苯酚>碳酸>乙酸,故A错误;
B、电子层结构相同,核电荷数越多半径越小,所以离子半径:O2->F->Na+>Mg2+,故B正确;
C、不同类型的晶体熔点高低,原子晶体>离子晶体>分子晶体,所以熔点的高低为::SiO2>NaCl>P4,故C错误;
D、相对分子质量越大,气态氢化物的熔沸点越大,但HF中含有氢键,则熔沸点为HF>HBr>HCl,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律,晶体的熔点比较,微粒半径大小的比较,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
4.下列物品或设备:
①水泥路桥 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.
所用材料为SiO2或要用到SiO2的是( )
①水泥路桥 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.
所用材料为SiO2或要用到SiO2的是( )
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
1.下列实验装置不能达到实验目的是 ( )
| A. | 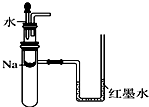 验证Na和水反应是否为放热反应 | B. | 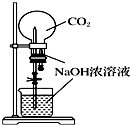 用CO2做喷泉实验 | ||
| C. |  观察纯碱的焰色反应 | D. | 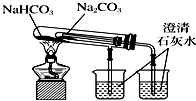 比较NaCO3、NaHCO3的稳定性 |
18.在下列化学反应中,不属于离子反应的是( )
| A. | 锌片投入到稀硫酸中 | B. | H2与O2点燃生成H2O | ||
| C. | 向澄清的石灰水中加入Na2CO3溶液 | D. | 向稀盐酸中滴加KOH溶液 |
19.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴乙烷制乙烯;由石油制乙烯 | |
| B. | 由乙醛制乙酸;由乙醛制乙醇 | |
| C. | 乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 | |
| D. | 由硝酸与苯反应制硝基苯;由硝酸与甘油反应制硝化甘油 |

 ,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1,
,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1, 键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.
键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.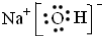
 CO32-+7H2O.
CO32-+7H2O.