题目内容
14.芳香族化合物ABCD只含C、H、O三种元素.A中的C、H、O质量分数分别为0.6506、0.0602、0.2892.A只有一个侧链且侧链无支链.ABCD的转化关系如图: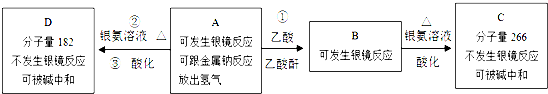
已知:同一个碳原子上连两个羟基不稳定,容易脱水.
请回答下列问题:
(1)A的分子式为C9H10O3
(2)B含有的官能团名称是醛基、酯基
(3)写出反应类型①取代反应、②氧化反应
(4)写出结构简式A
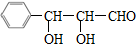 、C
、C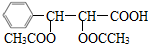
(5)写出A转化到D的②反应的化学方程式
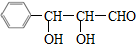 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$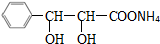 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O(6)满足下列条件的A的同分异构体共有2种,写出其中一种的结构简式
 (或
(或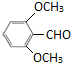 )
)①苯环上只有三个取代基 ②核磁共振氢谱中有四个信号峰 ③能发生银镜反应 ④无“-O-O-”结构.
分析 A中的C、H、O质量分数分别为0.6506、0.0602、0.2892,则A中C、H、O原子数之比为:$\frac{0.6506}{12}$:$\frac{0.0602}{1}$:$\frac{0.2892}{16}$=9:10:3,则A的最简式为:C9H10O3,该最简式的式量为166,根据A与银氨溶液反应后酸化得到相对分子质量为182的D可知,A的分子式与其最简式相同,都是C9H10O3;C9H10O3的不饱和度为:$\frac{9×2+2-10}{2}$=5,苯环的不饱和度为4,则A分子中还含有1个不饱和键,A能够发生银镜反应,则A分子中含有-CHO,所以A中其它结构都是饱和的,再经过“A只有一个侧链且侧链无支链”及“同一个碳原子上连两个羟基不稳定,容易脱水”可知A的结构简式为: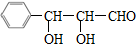 、D为
、D为 ;再根据A与乙酸酐、乙酸反应生成B,B与银氨溶液反应酸化后得到分子量为266的C,且C不能发生银镜反应,但能够发生中和反应可知,C中含有羧基,则C的结构简式为
;再根据A与乙酸酐、乙酸反应生成B,B与银氨溶液反应酸化后得到分子量为266的C,且C不能发生银镜反应,但能够发生中和反应可知,C中含有羧基,则C的结构简式为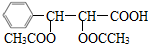 、B为
、B为 ,据此进行解答.
,据此进行解答.
解答 解:A中的C、H、O质量分数分别为0.6506、0.0602、0.2892,则A中C、H、O原子数之比为:$\frac{0.6506}{12}$:$\frac{0.0602}{1}$:$\frac{0.2892}{16}$=9:10:3,则A的最简式为:C9H10O3,该最简式的式量为166,根据A与银氨溶液反应后酸化得到相对分子质量为182的D可知,A的分子式与其最简式相同,都是C9H10O3;C9H10O3的不饱和度为:$\frac{9×2+2-10}{2}$=5,苯环的不饱和度为4,则A分子中还含有1个不饱和键,A能够发生银镜反应,则A分子中含有-CHO,所以A中其它结构都是饱和的,再经过“A只有一个侧链且侧链无支链”及“同一个碳原子上连两个羟基不稳定,容易脱水”可知A的结构简式为: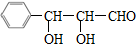 、D为
、D为 ;再根据A与乙酸酐、乙酸反应生成B,B与银氨溶液反应酸化后得到分子量为266的C,且C不能发生银镜反应,但能够发生中和反应可知,C中含有羧基,则C的结构简式为
;再根据A与乙酸酐、乙酸反应生成B,B与银氨溶液反应酸化后得到分子量为266的C,且C不能发生银镜反应,但能够发生中和反应可知,C中含有羧基,则C的结构简式为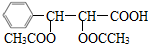 、B为
、B为 ,
,
(1)A的分子式为:C9H10O3,
故答案为:C9H10O3;
(2)B为 ,其分子中含有的官能团为:醛基、酯基,
,其分子中含有的官能团为:醛基、酯基,
故答案为:醛基;酯基;
(3)根据分析可知,反应①为取代反应,反应②为氧化反应,
故答案为:取代反应;氧化反应;
(4)根据分析可知,A的结构简式为: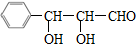 ,C的结构简式为:
,C的结构简式为: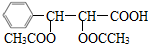 ,
,
故答案为: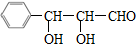 ;
;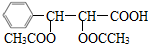 ;
;
(5)A转化到D的②反应的化学方程式: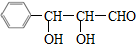 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$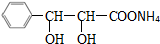 +3NH3+2Ag↓+H2O,
+3NH3+2Ag↓+H2O,
故答案为: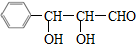 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$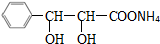 +3NH3+2Ag↓+H2O;
+3NH3+2Ag↓+H2O;
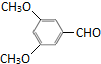
(6)A为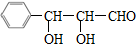 ,满足下列条件的A的同分异构体:
,满足下列条件的A的同分异构体:
①苯环上只有三个取代基 ②核磁共振氢谱中有四个信号峰,说明有机物分子中含有4种等效H; ③能发生银镜反应,说明分子中含有醛基:-CHO;④无“-O-O-”结构,则满足条件的有机物有: 、
、 ,总共有2种,
,总共有2种,
故答案为:2; (或
(或 ).
).
点评 本题考查了有机推断,题目难度中等,正确推断A的分子式、结构简式为解答关键,注意熟练掌握常见有机物结构与性质,试题侧重考查学生的分析、理解能力及化学计算能力,(6)为难点,注意掌握同分异构体的书写原则.

 名校课堂系列答案
名校课堂系列答案| A. | 常温下,氨水溶液加水稀释,$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| B. | 2SO2(g)+O2 (g)?2SO3(g)(△H<0),其它条件不变时,升高温度,v(正)增大、v(逆)减小,平衡正向移动 | |
| C. | 某容器中存在H2(g)+I2 (g)?2HI(g)反应,当减小容器体积时,气体颜色加深,各物质的百分含量不变 | |
| D. | 25℃时Mg(OH)2的Ksp小于MgF2的Ksp,则饱和Mg(OH)2与饱和MgF2相比,前者c(Mg2+)大 |
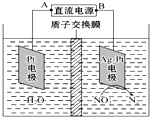
| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | 阴极反应式为2 NO3-+12H++10e-=N2↑+6H20 | |
| D. | 若电解过程中转移了2 mol电子,则左侧电解液的质量减少了16g |
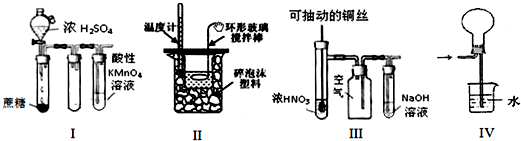
| A. | 实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. | 实验Ⅱ:中和热测定 | |
| C. | 实验Ⅲ:可用来制取并收集NO2 | |
| D. | 实验Ⅳ:可用于HCl气体的吸收 |
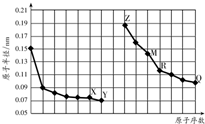
| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物的热稳定性:HQ>HY | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
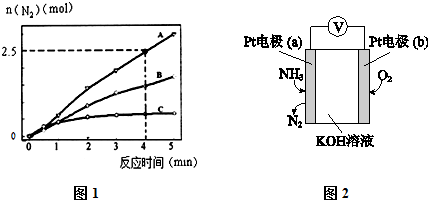
(2)相同条件下,反应Ⅰ在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,NO2体积分数不变(填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图2. 溶液中OH-向电极a移动(填a或b),负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.