题目内容
14.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.(1)A为C,B为O,C为Na.D的最高价氧化物的水化物是H2SO4.
(2)写出A、B的化合物与E反应的化学方程式:2Na2O2+CO2=2Na2CO3+O2
(3)画出B的离子结构示意图
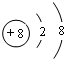 画出D的离子结构示意图
画出D的离子结构示意图
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素,D为S元素,D的最高价氧化物的水化物是H2SO4,
故答案为:C;O;Na;H2SO4;
(2)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2;
(3)B的离子为O2-,结构示意图为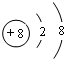 ,D的离子为S2-,结构示意图为
,D的离子为S2-,结构示意图为 :,
:,
故答案为: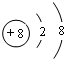 ;
; ;
;
(4)D的最高价氧化物的水化物的化学式是H2SO4,与碳反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意对基础知识的积累掌握.

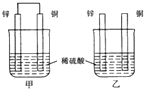
| A. | 两烧杯中溶液的pH均增大 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲、乙溶液均变蓝色 |

| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的 Ksp约等于2.46×10-6 | |
| D. | 向只含有Ca(OH)2 和Mg(OH)2]两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$比值不变 |
| -C═C- | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2 L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: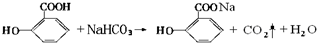 ;
;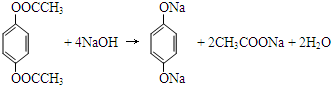 .
.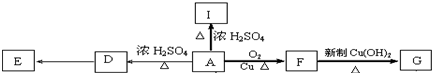 .
. E
E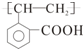 ;
;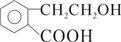 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2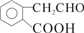 +2H2O
+2H2O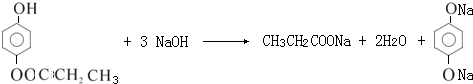 .
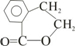
. .
.