题目内容
16.将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )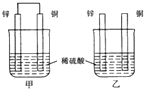
| A. | 两烧杯中溶液的pH均增大 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲、乙溶液均变蓝色 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,所以两烧杯中溶液的pH均增大,故A正确;
B.乙不是原电池反应,故B错误;
C.乙中铜与稀硫酸不反应,锌片上有气泡,故C错误;
D.铜没有被氧化生成铜离子,溶液不变蓝,故D错误.
故选A.
点评 本题考查了置换反应和原电池的有关知识,为高频考点,侧重元素化合物知识的综合理解以及原电池知识的理解和运用的考查,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2).则下列叙述中正确的是( )
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
4.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为14NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
11.将钠投入到滴有石蕊试液的水中,下列有关现象的叙述中,错误的是( )
| A. | 钠浮在水面上 | B. | 钠熔化成小球并在水面上游动 | ||
| C. | 有无色无味的气体生成 | D. | 水溶液变为红色 |
1.将5.1g镁铝合金溶于70mL 4mol/L硫酸中,当合金完全溶解后,再加入70mL 8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为( )
| A. | 0.2 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
13.活性氧化锌是一种多功能的新型无机材料,某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图:
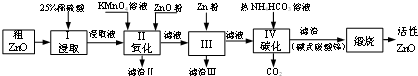
已知各相关氢氧化物沉淀pH范围如下表所示:
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要D(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤Ⅱ中通过加入KMnO4的作用是MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O(用离子方程式表示);
(3)用ZnO调节pH,可以除去含铁杂质.检验Fe3+是否沉淀完全的实验操作是取少量溶液,滴加KSCN溶液,无颜色变化,说明沉淀完全,反应沉淀不完全,调节pH的适宜范围是4.1~4.7;
(4)步骤Ⅲ中加入Zn粉的作用是:①除去溶液中的Cu2+;②进一步调节溶液pH;
(5)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是NH4HCO3分解导致损失.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解,滴入几滴甲基橙,
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
判断滴定终点的方法是溶液颜色由红色变为黄色,且半分钟不变色,所得活性氧化锌的纯度为97.2%;
(7)已知常温下,CuS的溶度积常数Ksp=6.0×10-36,物质的量浓度为3.0×10-3mol•L-1Na2S溶液与等体积的CuSO4溶液中混合后立即产生沉淀,则CuSO4的浓度最小为4.0×10-33mol•L-1.

已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要D(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤Ⅱ中通过加入KMnO4的作用是MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O(用离子方程式表示);
(3)用ZnO调节pH,可以除去含铁杂质.检验Fe3+是否沉淀完全的实验操作是取少量溶液,滴加KSCN溶液,无颜色变化,说明沉淀完全,反应沉淀不完全,调节pH的适宜范围是4.1~4.7;
(4)步骤Ⅲ中加入Zn粉的作用是:①除去溶液中的Cu2+;②进一步调节溶液pH;
(5)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是NH4HCO3分解导致损失.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解,滴入几滴甲基橙,
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
判断滴定终点的方法是溶液颜色由红色变为黄色,且半分钟不变色,所得活性氧化锌的纯度为97.2%;
(7)已知常温下,CuS的溶度积常数Ksp=6.0×10-36,物质的量浓度为3.0×10-3mol•L-1Na2S溶液与等体积的CuSO4溶液中混合后立即产生沉淀,则CuSO4的浓度最小为4.0×10-33mol•L-1.
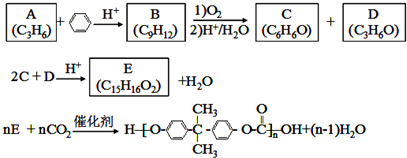
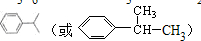 ;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.
;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$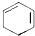 +2NaBr+2H2O.
+2NaBr+2H2O.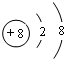 画出D的离子结构示意图
画出D的离子结构示意图