题目内容
4.NA表示阿伏伽德罗常数,下列叙述正确的是( )| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2 L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
分析 A、亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
B、硫酸根带2个单位的负电荷;
C、Na2O2由2个钠离子和1个过氧根构成;
D、反应中部分硝酸根中N元素由+5价降低为氮气中0价,铵根中N元素-3价升高为氮气中0价,氮气既是还原产物又是氧化产物,由氮原子守恒,结合方程式可知,还原产物与氧化产物物质的量之比为3:5,根据n=$\frac{m}{M}$计算氮气物质的量,再计算氧化产物物质的量,再结合铵根中N元素化合价变化计算转移电子物质的量.
解答 解:A.1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故A错误;
B、2L0.5mol•L-1硫酸钾溶液中SO42-的物质的量n=CV=0.5mol/L×2L=1mol,而1个硫酸根带2个单位的负电荷,所以1mol硫酸钾中SO42-所带电荷数为2NA,但溶液中的阴离子除了SO42-还有OH-,故溶液中阴离子所带的电荷数大于2NA个,故B错误;
C、Na2O2由2个钠离子和1个过氧根构成,故1molNa2O2中共含3mol离子即3NA个,故C错误;
D、反应中部分硝酸根中N元素由+5价降低为氮气中0价,铵根中N元素-3价升高为氮气中0价,氮气既是还原产物又是氧化产物,由氮原子守恒,结合方程式可知,还原产物与氧化产物物质的量之比为3:5,生成氮气物质的量为$\frac{28g}{28g/mol}$=1mol,故氧化产物的物质的量为1mol×$\frac{5}{8}$=$\frac{5}{8}$mol,铵根中N元素被氧化,故转移电子为$\frac{5}{8}$mol×2×[0-(-3)]=3.75mol,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | Na与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
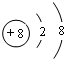 画出D的离子结构示意图
画出D的离子结构示意图
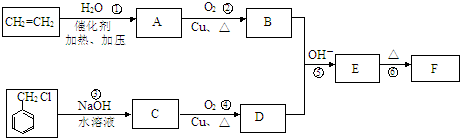
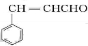 .E中含氧官能团的名称为醛基和羟基.
.E中含氧官能团的名称为醛基和羟基.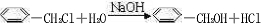 .写出有关反应的类型:②氧化反应⑥消去反应.
.写出有关反应的类型:②氧化反应⑥消去反应.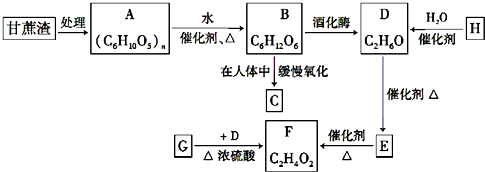
 ;
;
 或
或 (写结构简式).
(写结构简式). ;D→E
;D→E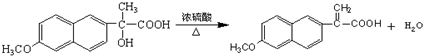 .
.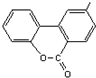 和
和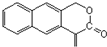 ,则鉴别G和H的试剂为溴水或溴的四氯化碳溶液.
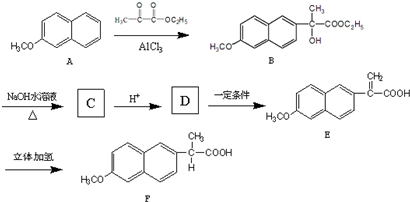
,则鉴别G和H的试剂为溴水或溴的四氯化碳溶液.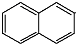 )的A的同分异构体中,其中能与NaOH溶液反应的有11种;能发生酯化反应的有
)的A的同分异构体中,其中能与NaOH溶液反应的有11种;能发生酯化反应的有 (写结构简式).
(写结构简式).