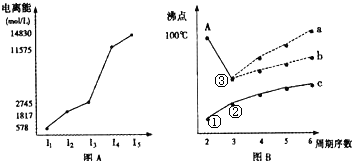
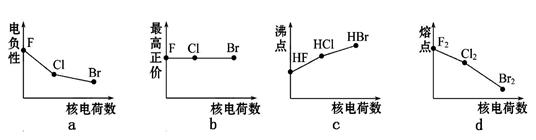
题目内容
下列各组顺序不正确的是( )
| A.微粒半径大小:S2->Cl->F->Na+>Al3+ |
| B.热稳定性大小:SiH4<PH3<NH3<H2O<HF |
| C.熔点高低:石墨>食盐>干冰>碘晶体 |
| D.沸点高低:NH3>AsH3>PH3 |
C
试题分析:A、离子核外电子层数越多,离子半径越大。核外电子排布相同的微粒,核电荷数越大离子半径越小,故离子半径S2->Cl->F->Na+>Al3+,故A正确;B、非金属性F>O>N>P>Si,非金属性越强,氢化物的稳定性越强,故稳定性是SiH4<PH3<NH3<H2O<HF,故B正确;C、熔点的一般规律:原子晶体>离子晶体>分子晶体。对于分子晶体分子间作用力越大,熔沸点越高,所以熔点:金刚石>食盐>碘晶体>干冰,故C错误;D、氨气分子间存在氢键,沸点高于砷化氢和磷化氢的,故D正确;故选C。

练习册系列答案
相关题目

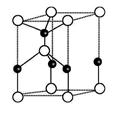
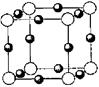 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。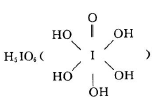 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。