题目内容
下列说法正确的是
| A.沸点:H2O>H2S>H2Se>H2Te | B.稳定性:SiH4>PH3>H2S >HCl |
| C.熔点:SiC >KCl> I2>CO2 | D.沸点:CH4 >SiH4>GeH4>SnH4 |
C
试题分析:A.这些都是同族元素形成的氢化物,结构相似。对于结构相似的物质,一般情况下,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,但是由于在水的分子之间存在氢键,增加了分子之间的相互作用。所以沸点变化规律是:H2O>H2Te>H2Se >H2S。错误。B.元素的非金属性越强,其对应的简单氢化物的稳定性就越强,由于非金属性:Cl>S>P>Si,稳定性:SiH4< PH3< H2S < HCl 。错误。C.一般情况下,各类晶体的熔沸点规律是:原子晶体>离子晶体>分子晶体。对于分子晶体来说相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高。SiC属于原子晶体;KCl属于离子晶体;I2和CO2属于分子晶体,因此熔点:SiC >KCl> I2>CO2。正确。D.这些氢化物结构相似。相对分子质量越大,分子间作用力就越大。物质的沸点就越高。因此沸点:CH4 < SiH4< GeH4< SnH4。错误。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目

 )和对羟基苯甲醛(
)和对羟基苯甲醛(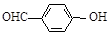 )的沸点
)的沸点