题目内容
4.对下列流程有关判断正确的是( )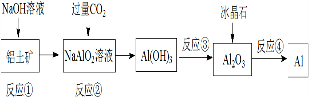
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为HCO3- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应④的条件是高温加热 |
分析 A、电解熔融Al2O3的反应属于氧化还原反应;
B、偏铝酸盐中通过量二氧化碳来获得氢氧化铝沉淀和碳酸氢钠;
C、加热分解氢氧化铝固体应在坩埚中进行;
D、反应④为电解熔融Al2O3制备铝单质.
解答 解:A、电解熔融Al2O3的反应属于氧化还原反应,反应的方程式为2Al2O3(熔融)$\frac{\underline{\;冰晶石\;}}{电解}$4Al+3O2↑,故A错误;
B、偏铝酸盐中通过量二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C、反应③为加热分解氢氧化铝固体应在坩埚中进行,故C错误;
D、反应④为电解熔融Al2O3制备铝单质,所以条件是电解熔融,故D错误.
故选B.
点评 本题是一道物质制备流程分析题,题目涉及氧化还原反应、实验仪器的使用等,考查学生分析和解决问题的能力,综合性强,题目难度中等.

练习册系列答案
相关题目
14.2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )

| A. | 异胡薄荷醇的分子式为C10H17O | |
| B. | 异胡薄荷醇在NaOH醇溶液中可发生消去反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
15.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=1的溶液中:Fe2+、K+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | c (Fe3+)=0.1 mol•L-1 的溶液中:Na+、NO${\;}_{3}^{-}$、SCN-、SO${\;}_{4}^{2-}$ | |
| C. | 使酚酞试液变红色的溶液中:Na+、Ba2+、I-、Cl- | |
| D. | 水电离的c (H+)=1×10-13mol•L-1的溶液中:K+、Na+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
12.在下列自然资源的开发利用中,不涉及化学变化的是( )
| A. | 用铁矿石冶炼铁 | B. | 用食醋清除暖水瓶中的水垢 | ||
| C. | 用煤生产水煤气 | D. | 干冰放在通风处自然升华 |
19.下列有关物质的性质或应用正确的是( )
| A. | Na2O用作呼吸面具的供氧剂 | |
| B. | 氧化铝常用于制造耐火材料 | |
| C. | 米汤可检验碘盐中的碘酸钾 | |
| D. | 食品包装袋内放入生石灰可以防止食品因氧化而变质 |
16.氨基钠和氢化钠与水反应的化学反应如下:①NaNH2+H2O═NaOH+NH3↑②NaH+H2O═NaOH+H2↑,下列叙述正确的是( )
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 氨基钠和氢化钠的晶体中都只含离子键 | |
| D. | 方程式①中,氨基钠是还原剂 |
13.下列反应中,Na2O2只表现出氧化性的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2H2SO4═2Na2SO4+2H2O+O2↑ | |
| C. | Na2O2+SO2═Na2SO4 | |
| D. | 5Na2O2+2KMnO4+8H2SO4═SNa2SO4+K2SO4+2MnSO4+5O2↑+8H2O |
14.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯.用铅笔写一个字消耗石墨的质量约为5×10-4克.那么一个铅笔字含有的碳原子数约为( )
| A. | 2.5×1022个 | B. | 2.5×1019个 | C. | 5×1022个 | D. | 5×1019个 |
 .
.