题目内容
13.下列反应中,Na2O2只表现出氧化性的是( )| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2H2SO4═2Na2SO4+2H2O+O2↑ | |
| C. | Na2O2+SO2═Na2SO4 | |
| D. | 5Na2O2+2KMnO4+8H2SO4═SNa2SO4+K2SO4+2MnSO4+5O2↑+8H2O |
分析 Na2O2只表现出氧化性不表现出还原性,说明Na2O2在反应中只得电子化合价降低,据此分析解答.
解答 解:A.该反应中Na2O2中O元素化合价由-1价变为0价和-2价,所以Na2O2表现出氧化性和还原性,故A错误;
B.该反应中Na2O2中O元素化合价由-1价变为0价和-2价,所以Na2O2表现出氧化性和还原性,故B错误;
C.该反应Na2O2中O元素化合价由-1价变为-2价、S元素化合价由+4价变为+6价,所以Na2O2只作氧化剂、二氧化硫作还原剂,则Na2O2只表现出氧化性不表现出还原性,故C正确;
D.该反应中Na2O2中O元素化合价由-1价变为0价、Mn元素化合价由+7价变为+2价,所以过氧化钠是还原剂、高锰酸根离子是氧化剂,则过氧化钠只体现出还原性,故D错误;
故选C.
点评 本题考查物质的氧化性、还原性,侧重考查基本概念,明确元素化合价变化是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
相关题目
3.${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca两种原子,它们具有相同的( )
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 电子数 |
4.对下列流程有关判断正确的是( )
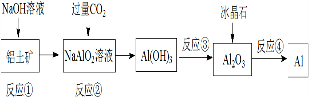

| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为HCO3- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应④的条件是高温加热 |
1.五种不同元素X、Y、Z、D、E、F的信息如下:
请回答下列问题:
(1)Z在周期表中的位置第三周期第ⅥA族,D的最高价氧化物对应水化物的电子式为
(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是2Fe3++2I-═2Fe2++I2(用离子方程式表示).
(4)E单质在发生吸氧腐蚀时的正极反应方程式O2+2H2O+4e-═4OH-
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
| 元素 | 有关信息 |
| X | 元素主要常见化合价为-2和-1价,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其气态氢化物与Y单质发生反应生成淡黄色固体. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
| F | 元素所在的主族序数等于周期序数. |
(1)Z在周期表中的位置第三周期第ⅥA族,D的最高价氧化物对应水化物的电子式为

(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是2Fe3++2I-═2Fe2++I2(用离子方程式表示).
(4)E单质在发生吸氧腐蚀时的正极反应方程式O2+2H2O+4e-═4OH-
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
3.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol CO2中含有原子数NA | |
| B. | 1L1mol/L的硫酸钠溶液中,所含Na+数为NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5NA | |
| D. | 1mol Fe含有原子数NA |
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.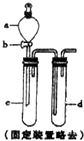 某兴趣小组采用如图装置制取并探究SO2气体的性质.
某兴趣小组采用如图装置制取并探究SO2气体的性质.