题目内容
16.氨基钠和氢化钠与水反应的化学反应如下:①NaNH2+H2O═NaOH+NH3↑②NaH+H2O═NaOH+H2↑,下列叙述正确的是( )| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 氨基钠和氢化钠的晶体中都只含离子键 | |
| D. | 方程式①中,氨基钠是还原剂 |
分析 A、NaNH2与盐酸反应生成氯化钠与氯化铵;
B、根据方程式②中氢的化合价变化来分析;
C、NaNH2中氮与氢之间为共价键;
D、根据反应方程式中是否有化合价变化来分析;
解答 解:A、NaNH2与盐酸反应生成氯化钠与氯化铵,故A错误;
B、方程式②中NaH中的氢为-1价,H2O的氢为+1价,反应后都生成0价的氢气,所以每生成1molH2转移1mol电子,故B正确;
C、NaNH2中氮与氢之间为共价键,故C错误;
D、由方程式①中没有化合价变化,所以为非氧化还原反应,故D错误;
故选:B.
点评 以NaNH2和NaH为载体,考查氧化还原反应、电子转移、化学键的判断等,难度中等,理解与反应的本质是关键.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
6.煤粉在隔绝空气条件下加强热,除主要得到焦炭外,还能得到下表所列的物质:
(1)表中所列物质不属于有机物的是②⑥(填序号).
(2)能因发生反应而使溴水褪色的是③⑥(填序号).
(3)能发生加聚反应、生成物可用作制造食品包装袋的是③(填序号),该物质与氢气反应的化学方程式CH2=CH2+H2$→_{△}^{催化剂}$CH3CH3.
(4)甲苯的一氯取代产物有4种.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 氨水 |
(2)能因发生反应而使溴水褪色的是③⑥(填序号).
(3)能发生加聚反应、生成物可用作制造食品包装袋的是③(填序号),该物质与氢气反应的化学方程式CH2=CH2+H2$→_{△}^{催化剂}$CH3CH3.
(4)甲苯的一氯取代产物有4种.
4.对下列流程有关判断正确的是( )
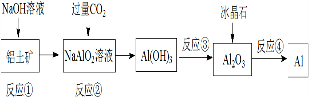

| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为HCO3- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应④的条件是高温加热 |
11.化学与生产、生活密切相关,下列有关说法不正确的是:( )
| A. | 同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域 | |
| B. | iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够,导致氧化膜不够致密 | |
| C. | 在日光照射下,NO2与空气中的一些碳氢化合物发生作用后,产生了光化学烟雾 | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料 |
1.五种不同元素X、Y、Z、D、E、F的信息如下:
请回答下列问题:
(1)Z在周期表中的位置第三周期第ⅥA族,D的最高价氧化物对应水化物的电子式为
(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是2Fe3++2I-═2Fe2++I2(用离子方程式表示).
(4)E单质在发生吸氧腐蚀时的正极反应方程式O2+2H2O+4e-═4OH-
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
| 元素 | 有关信息 |
| X | 元素主要常见化合价为-2和-1价,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其气态氢化物与Y单质发生反应生成淡黄色固体. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
| F | 元素所在的主族序数等于周期序数. |
(1)Z在周期表中的位置第三周期第ⅥA族,D的最高价氧化物对应水化物的电子式为

(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是2Fe3++2I-═2Fe2++I2(用离子方程式表示).
(4)E单质在发生吸氧腐蚀时的正极反应方程式O2+2H2O+4e-═4OH-
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
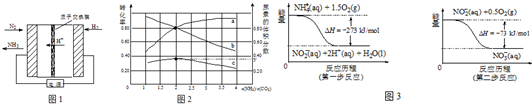
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.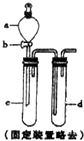 某兴趣小组采用如图装置制取并探究SO2气体的性质.
某兴趣小组采用如图装置制取并探究SO2气体的性质.