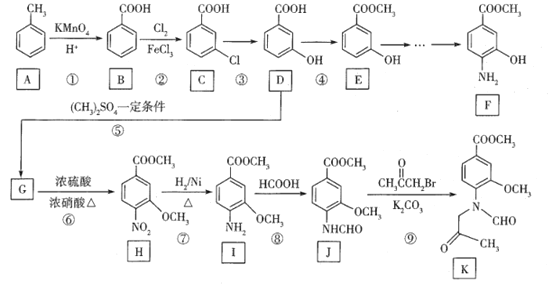
题目内容
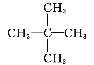
【题目】三元电池成为我国电动汽车的新能源,其电极材料可表示为![]() ,且
,且![]() 。充电时电池总反应为:
。充电时电池总反应为:![]() ,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的
,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的

A.充电时,A为阴极,![]() 被氧化
被氧化
B.允许离子X通过的隔膜属于阴离子交换膜
C.可从无法充电的废旧电池的石墨电极中回收大量金属锂
D.放电时,正极反应式为:![]()
【答案】D
【解析】
充电时电池总反应为![]() ,逆过程是放电时的反应,放电时,正极B是得电子的还原反应,反应式为
,逆过程是放电时的反应,放电时,正极B是得电子的还原反应,反应式为![]() ,A是负极,金属锂失电子的氧化反应,充电时,电源的负极连接电池的负极,据此回答。
,A是负极,金属锂失电子的氧化反应,充电时,电源的负极连接电池的负极,据此回答。
A.A是电池的负极,充电时,A为阴极,发生还原反应,故A错误;
B. 放电时,正极B是得电子的还原反应,反应式为![]() ,允许离子X通过的隔膜即允许阳离子通过,应该是属于阳离子交换膜,故B错误;
,允许离子X通过的隔膜即允许阳离子通过,应该是属于阳离子交换膜,故B错误;
C.金属锂镶嵌在石墨中,是合金,不能从无法充电的废旧电池的石墨电极中回收金属锂,故C错误;
D.放电时,正极B是得电子的还原反应,反应式为![]() ,故D正确。
,故D正确。
故答案选:D。

练习册系列答案
相关题目