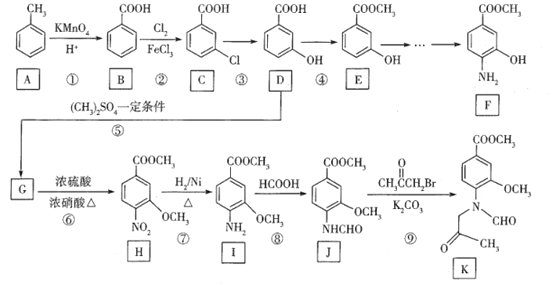
题目内容
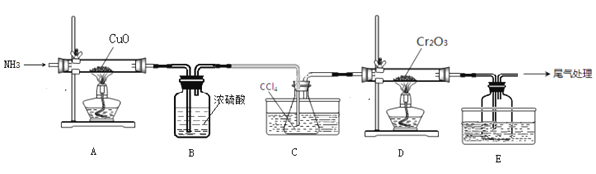
【题目】据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
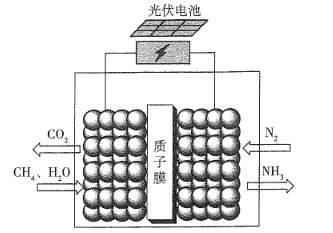
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
【答案】B
【解析】
A. 根据图中信息分析,CH4化合价升高变为CO2,因此左边为阳极,阳极的电极反应式为CH4+2H2O 8e- = CO2 +8H+,故A错误;
B. 根据A选项分析,左边为阳极,右边为阴极,阴极主要是氮气得到电子变为氨气,可能发生副反应2H+ +2e-=H2 ↑,故B正确;
C. 根据电解池“异性相吸”原理,质子(H+)通过交换膜由阳极区向阴极区移动,故C错误;
D. 缺少标准状况,无法计算气体体积,故D错误。
综上所述,答案为B。

练习册系列答案
相关题目