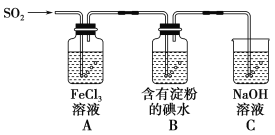
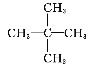
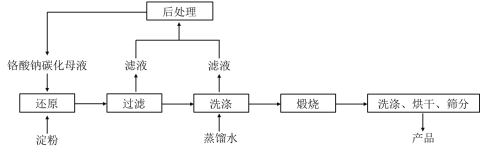
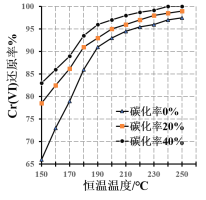
题目内容
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
(1)此时A的浓度为______;
(2)反应开始前放入容器中A、B的物质的量是_____________;
(3)B的平均反应速率是_________________;
(4)x值为____________。
【答案】0.75mol/L 3mol 0.05mol/(L·min) 2
【解析】
(1)根据c=n/V计算5min后A的浓度;
(2)由分析可知A、B起始物质的量;
(3)根据v=△c/△t计算v(B);
(4)结合C的速率计算x的值。
(1)将等物质的量的A、B混合于2L的密闭容器中,经过5分钟后,测得D的浓度为0.5mol/L,生成D的物质的量为1mol,则:
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) a a 0 0
变化量(mol) 1.5 0.5 0.5x 1
5min后(mol) a-1.5 a-0.5 0.5x 1
5min后c(A):c(B)=3:5,则(a-1.5):(a-0.5 )=3:5,解得a=3。
5min后A的浓度为(3-1.5)mol/2L=0.75mol/L,故答案为:0.75mol/L。
(2)由上述分析,可知A、B起始物质的量为3mol,故答案为:3mol。
(3)v(B)=(0.5mol/2L)/5min=0.05mol/(L·min),故答案为: 0.05mol/(L·min)。
(4)0.5xmol=0.1mol/(L·min)×5min×2L,解得x=2,故答案为:2。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目