题目内容
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有的OH-离子数目为0.2NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
分析 A.求出丙烷的物质的量,然后根据1mol丙烷中含10mol共价键来分析计算;
B.常温下pH=13的溶液中氢氧根离子浓度为0.1mol/L,根据n=cV计算出氢氧根离子的物质的量;
C.在NO2气体中存在平衡:2NO2?N2O4,导致气体体积偏小;
D.根据粗铜中含有杂质(铁)的摩尔质量比铜小,转移的电子的物质的量大于1mol分析.
解答 解:A.17.6g丙烷的物质的量为:n=$\frac{17.6g}{44g/mol}$=0.4mol,而1mol丙烷中含10mol共价键,故0.4mol丙烷中含4mol共价键,所含的共价键数目为4NA,故A正确;
B.常温下pH=13的溶液中氢氧根离子浓度为0.1mol/L,则1L该溶液中含有0.1mol氢氧根离子,含有的OH-离子数目为0.1NA,故B错误;
C.一氧化氮和氧气发生反应:2NO+O2═2NO2,分子数减少,反应后分子总数小于0.5NA,故C错误;
D.电解精炼铜时,若阳极质量减少64g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少64g,转移的电子的物质的量大于2mol,则阴极得到的电子数大于2NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,试题知识点较多,充分考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
5.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
17.用如图实验装置进行相应实验,装置正确且能达到实验目的是( )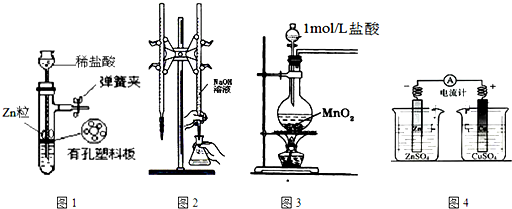

| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |
14.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图甲装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.(如图乙)下列说法错误的是( )
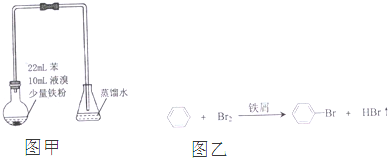

| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
1.化学与人类生产、生活,社会可持续发展密切相关,下列说法正确的是( )
| A. | 用厨房垃圾发酵制沼气属于物理变化 | |
| B. | 可用水作镁铝合金爆炸时的灭火剂 | |
| C. | 推广使用煤液化技术科减少温室气体二氧化碳的排放 | |
| D. | 超导材料K3C60在熔融状态下能够导电,说明K3C60是电解质 |
11.对下列装置的叙述错误的是( )


| A. | X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| B. | X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 | |
| C. | X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 | |
| D. | X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
18.下列实验的叙述正确的是( )
| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |