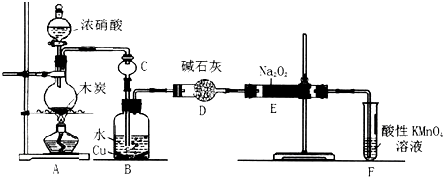
题目内容
10.“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥含有NaCl(15~20%)、Mg(OH)2(15~20%)、CaCO3(5~10%)、BaSO4(30~40%)和不溶于酸的物质(10~15%),为了生产七水硫酸镁,设计了如图1的工艺流程: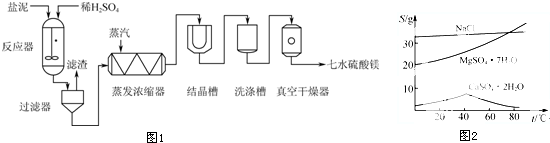
(1)电解食盐水前,为除去食盐水中的Mg2+、Ca2+、SO${\;}_{4}^{2-}$等杂质离子,下列试剂加入的先后顺序合理的是D(填字母).
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(2)反应器中发生两个转化,写出其中一个反应的化学方程式:CaCO3+H2SO4=CaSO4+H2O+CO2↑或Mg(OH)2+H2SO4=MgSO4+2H2O.
(3)三种化合物的溶解度(S)随温度变化曲线如图2,在过滤器中需要趁热过滤,其主要原因是温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4•2H2O溶解度小);滤渣的主要成分除不溶于酸的物质外另外两种为硫酸钡(BaSO4)、硫酸钙(CaSO4或CaSO4•2H2O).
(4)在蒸发浓缩器中通入高温水蒸气并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是氯化钠(NaCl).
(5)洗涤槽中洗涤晶体的目的是除去晶体表面的杂质,检验晶体表面的Cl-已洗涤干净的方法是取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.
分析 (1)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析;
(2)盐泥中的碳酸钙、氢氧化镁分别与稀硫酸反应;
(3)根据图2中温度对CaSO4•2H2O晶体的影响分析原因;滤渣中含有硫酸钡和硫酸钙等物质;
(4)根据温度对氯化钠、硫酸镁、硫酸钙晶体的影响判断析出的主要成分;
(5)检验氯离子通常使用硝酸银溶液,不过检验氯离子前需要除去干扰离子硫酸根离子.
解答 解:(1)加入的钡离子可以由碳酸钠除去,故最后加碳酸钠,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,所以D正确,
故答案为:D;
(2)盐泥中的碳酸钙、氢氧化镁分别与硫酸反应,反应的化学方程式为:CaCO3+H2SO4=CaSO4+H2O+CO2↑、Mg(OH)2+H2SO4=MgSO4+2H2O,
故答案为:CaCO3+H2SO4=CaSO4+H2O+CO2↑或Mg(OH)2+H2SO4=MgSO4+2H2O;
(3)在蒸发浓缩的过程中,温度大于40℃时随温度升高CaSO4•2H2O晶体溶解度降低,故会析出CaSO4•2H2O晶体,且应该趁热过滤,防止温度降低CaSO4•2H2O的溶解度变大,又重新溶解,不利于钙盐和镁盐的分离;同时温度降低硫酸镁晶体会析出,造成产量损失;滤渣的主要成分有不溶于酸的物质、盐泥中含有的硫酸钡,蒸发酒精出来的硫酸钙,
故答案为:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4•2H2O溶解度小);硫酸钡(BaSO4)、硫酸钙(CaSO4或CaSO4•2H2O);
(4)根据图象可知,在蒸发浓缩器中通入高温水蒸汽并控制温度在100~110℃蒸发结晶,CaSO4•2H2O的溶度积非常小,此时析出的晶体主要是:氯化钠,
故答案为:氯化钠(NaCl);
(5)滤液中的硫酸根离子会影响氯离子的干扰,应该先除去硫酸根离子,再检验氯离子,方法为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.
故答案为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.
点评 本题主要考查了盐的性质、除杂的方法和原则,题目难度中等,注意除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.

| A. | Al | B. | Zn | C. | Fe | D. | Na |
| A. | 明矾溶液重加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O═CaSO4↓+2HClO | |
| C. | NaHCO3溶液与少量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 向过量苏打溶液中逐滴加入少量稀硫酸:CO32-+OH+=HCO3- |
| A. | 原子半径最小的是F | B. | 所含元素种类最多的族是第VIII族 | ||
| C. | 金属元素的种类多于非金属元素 | D. | 第n周期第n主族的元素均为金属 |
| A. | 两极共生成三种气体 | |
| B. | 阴极反应式为:Ag++e-═Ag | |
| C. | 阳极始终发生“2Cl--2e-═Cl2↑”的反应 | |
| D. | 向电解后的溶液中通入适量的HCl气体可使溶液复原到电解前的状态 |
(2)某正二价阳离子核外电子排布式为[Ar]3d5,该金属的元素符号为Mn.
(3)微粒间存在非极性键、配位键、氢键及范德华力的是E.
A.NH4Cl晶体 B.Na3AlF6晶体 C.Na2CO3•10H2O晶体 D.CuSO4溶液 E.CH3COOH溶液
(4)部分共价键键能数据如表:
| 共价键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氧酸 | |
| 含氧酸 | Cl-OH | 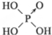 |  | 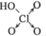 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
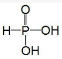 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式
 .铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0 g/cm3.
.铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0 g/cm3.