题目内容
15.下列有关元素周期表的叙述正确的是( )| A. | 原子半径最小的是F | B. | 所含元素种类最多的族是第VIII族 | ||
| C. | 金属元素的种类多于非金属元素 | D. | 第n周期第n主族的元素均为金属 |
分析 A.同主族从上到下原子半径增大,同周期从左到右原子半径增大;
B.元素种类最多的族是第IIB族;
C.主族元素中部分元素和零族是非金属元素;
D.第一周期第IA族的元素为非金属元素.
解答 解:A.同主族从上到下原子半径增大,同周期从左到右原子半径增大,则原子半径最小的是H,故A错误;
B.元素种类最多的族是第IIB族,第IIB中含有镧系元素和锕系元素,故B错误;
C.主族元素中部分元素和零族是非金属元素,过度元素全部是金属元素,金属元素的种类多于非金属元素,故C正确;
D.第一周期第IA族的元素是H元素,为非金属元素,则第n周期第n主族的元素不一定为金属,故D错误.
故选C.
点评 本题考查元素周期表的结构,注意把握元素在周期表的位置及短周期、第IIB族即可解答,明确结构、位置为解答的关键,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
17.下列实验操作正确的是( )
| A. | 用溶解和过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 用分液的方法除去酒精中的少量水 | |
| C. | 用蒸馏的方法分离水和四氯化碳的混合物 | |
| D. | 用结晶的方法提纯含有少量KCl的KNO3晶体 |
18.某地酸雨经检验除含H+外[C(OH)-以及其他微量的离子浓度忽略]还有Na+,Cl-,NH4+,SO42-其浓度见表:
(1)试计算混合液中H+的浓度3.5×10-3mol•L-1.
(2)取1mL该酸雨,若完全反应消耗NaOH的物质的量为3.5×10-6mol.
(3)若只用一份该酸雨样品检验其中Cl-和SO42-应先加Ba(OH)2(填化学式)待沉淀完全后再加AgNO3(填化学式).
(4)在问题(3)中判断已沉淀完全可加第二份沉淀剂的具体操作方法为取加入氢氧化钡以后的溶液少量,向其中加入少量的盐酸,看是否产生无色气体,若没有气体产生,证明硫酸根离子沉淀完全.
| 离子种类 | Na+ | Cl- | NH4+ | SO42- |
| 离子浓度 | 2.3×10-5mol/L | 3.5×10-5mol/L | 7×10-6mol/L | 2.4×10-6mol/L |
(2)取1mL该酸雨,若完全反应消耗NaOH的物质的量为3.5×10-6mol.
(3)若只用一份该酸雨样品检验其中Cl-和SO42-应先加Ba(OH)2(填化学式)待沉淀完全后再加AgNO3(填化学式).
(4)在问题(3)中判断已沉淀完全可加第二份沉淀剂的具体操作方法为取加入氢氧化钡以后的溶液少量,向其中加入少量的盐酸,看是否产生无色气体,若没有气体产生,证明硫酸根离子沉淀完全.
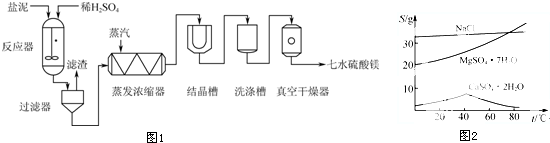
3.CuS04是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )


| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖溶液 | |
| C. | 利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol | |
| D. | 途径①所用混酸中H2S04与HN03物质的量之比最好为3:2 |
20.将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g);△H<0.当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | Z的体积分数变大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| A. | A | B. | B | C. | C | D. | D |
7.华裔科学家高锟发明的光导纤维被称为信息时代的神经.光导纤维属于( )
| A. | 无机非金属材料 | B. | 金属材料 | C. | 有机高分子材料 | D. | 复合材料 |
4.某有机物M的结构简式如下: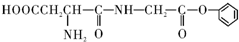 下列有关M的叙述中正确的是( )
下列有关M的叙述中正确的是( )
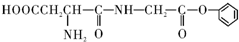 下列有关M的叙述中正确的是( )
下列有关M的叙述中正确的是( )| A. | M的分子式为:C12H15O5N2 | |
| B. | M可以发生水解反应、中和反应、加成反应、消去反应 | |
| C. | M的水解产物中一定含有醇类 | |
| D. | 1 molM最多可以与1L4mol/L的NaOH溶液完全反应 |
5.下列微粒中与OH-离子具有不同的质子数和相同的电子数的是( )
| A. | F- | B. | O2- | C. | Cl- | D. | K+ |