题目内容
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)“三酸”与“两碱”之间均可反应,酸过量时, 若用化学方程式表示有六个,若用离子方程式表示却只有两个,一个是H++OH-=H2O,请写出另一个离子方程式: 。
(2) 实验室制备H2、CO2、NH3、SO2时,用盐酸和稀硫酸可制备的相同气体是_______。
(3)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
① ;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,再将溶液蒸干,最终得到固体的质量为 g。
(5)利用侯德榜制碱法可制两碱的一种,请写出制取小苏打时在溶液中发生反应的总化学方程式 。
(1)CO32-+2H+=H2O+CO2↑ (2分)
(2)H2(2分)
(3)Na2CO3和NaOH (2分)
(4)5.85g (2分)
(5)H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl (2分)
解析试题分析:(1)碳酸钠因其水溶液显现碱性而俗称纯碱。在物质的分类上属于盐。酸都电离产生氢离子H+,氢氧化钠电离产生OH-, Na2CO3电离产生CO32-,故发生上述两个离子反应,除了H++OH-=H2O,肯定有纯碱Na2CO3,写离子方程式应该是CO32-+2H+=H2O+CO2↑。
(2) 实验室制备H2用盐酸和稀硫酸可制备、实验室制备CO2只能用盐酸和碳酸钙制备,不能用稀硫酸、NH3实验室制备用氯化铵和氢氧化钙固体、SO2实验室制备用Na2SO3和浓硫酸,综上所述,相同气体是氢气。
(3)在NaOH溶液中通人一定量的CO2后,溶液中的溶质的组成分析:用数轴表示为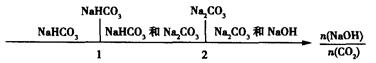
当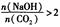 时,溶质的组成为NaOH和Na2CO3;当
时,溶质的组成为NaOH和Na2CO3;当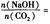 2时,溶质的组成为Na2CO3;当
2时,溶质的组成为Na2CO3;当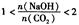 时,溶质的组成为Na2CO3和NaHCO3;当
时,溶质的组成为Na2CO3和NaHCO3;当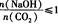 时,溶质的组成为NaHCO3。
时,溶质的组成为NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,说明全部转变成了氯化钠,氯化钠和氢氧化钠的物质的量相等,0.1 mol 氯化钠的质量为5.85gg。
(5)侯氏制碱法原理,是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。要制纯碱,先制得溶解度较小的NaHCO3。再利用碳酸氢钠不稳定性分解得到纯碱。要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子,铵根离子,氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。反应方程式为H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl。
考点:考查离子方程式的书写及化学计算等。

下列有关物质性质和应用叙述正确并且有因果关系的是
| A.烧碱具有碱性,能用于治疗胃酸过多 |
| B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟 |
| D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
 丙。则:
丙。则:①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为
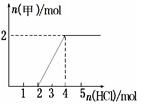
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2