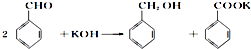
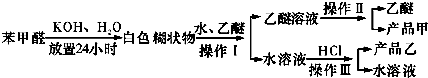题目内容
3.下列事实与氢键有关的是( )| A. | 水加热到很高温度都难以分解 | |
| B. | 氨易液化,氨极易溶于水 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
分析 氢键是一种特殊的分子间作用力,非化学键,只影响物质的物理性质,不影响化学性质,以此分析.
解答 解:A、水的分解破坏的是化学键,不是氢键,故A错误;
B、氨气分子之间也可以形成氢键,使得氨气的熔沸点都比较高,所以氨气易液化,氨与水分子之间易形成氢键,所以氨极易溶于水,故B正确;
C、CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高是与分子间作用力有关,分子间不存在氢键,与氢键无关,故C错误;
D、氢化物的稳定性是共价键的强弱决定的,与氢键无关,故D错误;
故选B.
点评 本题考查了氢键存在对物质性质的影响,题目难度不大,注意①氢键是一种分子间的相互作用,不属于化学键②能形成氢键的物质主要有NH3、H2O、HF③特征:比化学键弱,比分子间作用力强.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
| A. | 无机苯分子中只含有极性键 | |
| B. | 无机苯能发生加成反应和取代反应 | |
| C. | 无机苯的二氯取代物有3种同分异构体 | |
| D. | 无机苯不能使KMnO4酸性溶液褪色 |
12.下列叙述正确的是( )
| A. | 氧的摩尔质量为32 g/mol | |
| B. | 1 mol CO32-的质量为60 g/mol | |
| C. | H2SO4的摩尔质量等于H2SO4的相对分子质量 | |
| D. | 1 mol CO2的质量与CO2的相对分子质量在数值上相同 |
13.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的元素是F,可用于制半导体材料的元素是Si
(2)C元素在元素周期表中的位置是三周期ⅢA族.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(4)A分别与E、G、H形成的化合物中,最稳定的HF;
(5)在B、C、E、F中,原子半径最大的是Na.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(7)B、H两种元素形成的化合物所含的化学键类型为离子键
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3++6H+=2Al3++3H2O.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)C元素在元素周期表中的位置是三周期ⅢA族.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(4)A分别与E、G、H形成的化合物中,最稳定的HF;
(5)在B、C、E、F中,原子半径最大的是Na.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(7)B、H两种元素形成的化合物所含的化学键类型为离子键
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3++6H+=2Al3++3H2O.
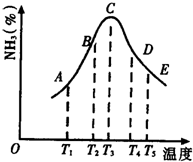 (1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
(1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图: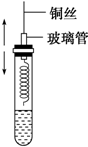 某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如图:
某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如图: $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
 .
.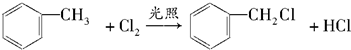 ;
; .
.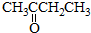
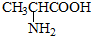 与
与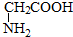
 与
与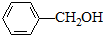
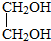 与
与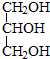
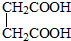 与
与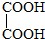
 ,并指出其中共平面的碳原子数目最多是4.
,并指出其中共平面的碳原子数目最多是4.