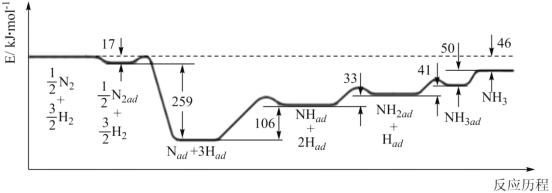
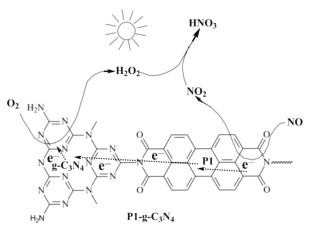
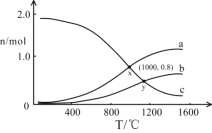
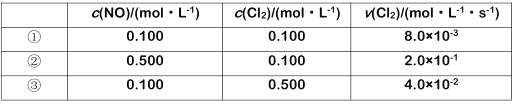
题目内容
【题目】(变式探究)在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有a/4 g HNO3被还原,则a∶b不可能为 ( )
A. 2∶1 B. 3∶1 C. 4∶1 D. 9∶2
【答案】A
【解析】
铁与稀HNO3的反应情况不能简单地一概而论,硝酸具有强氧化性,铁具有还原性,铁粉反应可能生成Fe2+或Fe3+或Fe2+与Fe3+,应根据Fe与HNO3二者物质的量相对多少的不同来讨论:恰好反应生成Fe3+,根据电子转移守恒计算a:b;恰好反应生成Fe2+,根据电子转移守恒计算a:b;恰好反应生成Fe2+与Fe3+,根据(1)、(2)的极限可知,该a:b介于上述两种情况之间。
Fe与HNO3反应时,根据铁的用量不同,反应可分为两种极端情况。
(1)若Fe过量,发生反应:3Fe+8HNO3(稀)=== 3Fe(NO3)2+2NO↑+4H2O
则有![]() =3∶8,解得:a:b=3:1
=3∶8,解得:a:b=3:1
此为a∶b的最小值。
(2)若HNO3过量,发生反应:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O
则有![]() =1∶1,解得:a:b=9:2
=1∶1,解得:a:b=9:2
此为a∶b的最大值。
所以a∶b的取值范围为3:1≤a:b≤9:2,即a∶b的比值在此范围内均合理,故选A。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目