��Ŀ����
����Ŀ�����ݷ�Ӧ��2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2���ش��������⣺
Na2SO4+Na2SnS3+2CO2���ش��������⣺
��1��������Ӧ�漰��Ԫ���У��ǽ�������ǿ��Ԫ�����������Ų�ʽΪ_____��
��������Ӧ���������У����ڷ��Ӿ���Ļ�����ĽṹʽΪ_____��
��2����������Ӧ�е������ʵ�ԭ�Ӻ����_____�ֲ�ͬ�˶�״̬�ĵ��ӣ���_____�ֲ�ͬ�����ĵ��ӡ�
��3��������Ӧ�У���������ǿ��Ԫ������Ԫ����Ƚϣ�������Ϊ�ж����߽�����ǿ�����ݵ���_____��ѡ���ţ���
a���ܷ��û�������ͭ��Һ�е�ͭ����
b��Al(OH)3�ܷ��ܽ��ڸ�Ԫ������������Ӧ��ˮ������
c����������������ʱʧȥ������Ŀ�Ķ���
d��������ͬŨ�ȵ�ϡ���ᷢ����Ӧ�ľ��ҳ̶�
��4��������Ӧ���������뻹ԭ�������ʵ���֮����_____��
��5�������£����Na2SnS3��ҺpH��7���������ӷ���ʽ������ԭ��_____
���𰸡�2s22p4 O��C��O 16 5 bd 3��1 SnS32��+H2OHSnS3��+OH��
��������
��1������Ԫ�������ڱ��е�λ�ÿ�֪���ǽ���Ԫ��ǿ��˳����O��S��C��
��2��ԭ�Ӻ����ж��ٸ����Ӿ��ж������˶�״̬���ж������ܼ����ж����ֲ�ͬ�����ĵ��ӣ�
��3��������Ӧ�н�������ǿ��Ԫ�����ƣ�������ǿ�����жϷ����У����������û������������׳̶ȡ�����֮����û���Ӧ����������������ˮ�������ǿ����
��4���÷�Ӧ��SԪ�ػ��ϼ���0�۱�Ϊ+6�ۺ�-2�ۣ�S�������������ǻ�ԭ����
��5��Na2SnS3��ҺpH��7��˵��Na2SnS3Ϊǿ�������Σ����������ˮ�����Һ�ʼ��ԣ�
��1���÷�Ӧ�зǽ���Ԫ��ǿ��˳����O��S��C�����Էǽ�������ǿ��Ԫ����OԪ�أ����������ӷֱ�λ��2s��2p�ܼ�����۵����Ų�ʽΪ2s22p4���÷�Ӧ�����ڷ��Ӿ���Ļ������Ƕ�����̼��������̼������ÿ��Oԭ�Ӻ�Cԭ���γ��������õ��Ӷԣ���ṹʽΪO��C��O��
��2��ԭ�Ӻ����ж��ٸ����Ӿ��ж������˶�״̬��SԪ��ԭ�Ӻ�����16�����ӣ�����Sԭ�Ӻ��������16���˶�״̬���ж������ܼ����ж����ֲ�ͬ�����ĵ��ӣ�Sԭ�Ӻ�����1s��2s��2p��3s��3p�����ܼ������������ֲ�ͬ�����ĵ��ӣ�
��3��a����������ˮ��Ӧ�������û�������ͭ��Һ�е�ͭ�����ܻ�������ͭ��Һ�е�ͭ�����ܱȽ��ƺ����Ľ�����ǿ�����ʲ�ѡa��
b��Al(OH)3���ܽ�������������Һ�У�˵�����������ļ���С��NaOH�������ܾݴ��жϽ�����ǿ������ѡb��
c����������������ʱʧȥ������Ŀ�Ķ��������������ǿ���أ��ʲ�ѡc��
d��������ͬŨ�ȵ�ϡ���ᷢ����Ӧ�ľ��ҳ̶����жϽ�����ǿ������ѡd��
��4���÷�Ӧ��SԪ�ػ��ϼ���0�۱�Ϊ+6�ۺͩ�2�ۣ�S�������������ǻ�ԭ�������������ͻ�ԭ�������ʵ���֮����3��1��
��5��Na2SnS3Ϊǿ�������Σ����������ˮ�����Һ�ʼ��ԣ���ˮ�ⷽ��ʽΪSnS32��+H2OHSnS3��+OH����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ͼ��ʾ����֤�������ʵ���ʵ�飬a��b��d��e�ǽ��������Һ����ֽ����KMnO4����μ�һ��Ũ�������������һ������������档��֪��2KMnO4��16HCl�D��2KCl��5Cl2����2MnCl2��8H2O
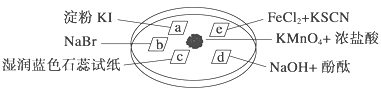
��ʵ������������ͻ��������ȷ���� (����)
ѡ�� | ʵ������ | ���ͻ���� |
A | a��������b�������ɫ | �����ԣ�Cl2>Br2>I2 |
B | c���ȱ�죬����ɫ | ������ˮ�������������� |
C | d��������ɫ | ������ˮ������Ư�������� |
D | e�����ɫ | ��ԭ�ԣ�Fe2��>Cl�� |
A. A B. B C. C D. D