题目内容
【题目】研究氮及其化合物的性质及转化,对研究自然界中氮的循环有着重大的意义。
I.合成氨反应历程研究
(1)科学家研究利用铁触媒合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
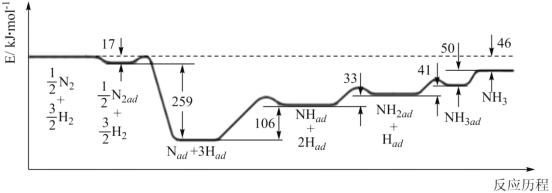
由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=__kJ·mol-1。该历程中速率最慢的一步的化学方程式为__。
2NH3(g)的H=__kJ·mol-1。该历程中速率最慢的一步的化学方程式为__。
II.对NO与O2反应的研究
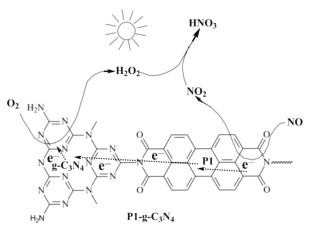
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,则Pl端的反应为__。
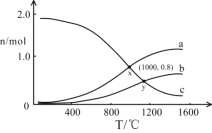
(3)在一定条件下,将2molNO和1molO2通入恒容密闭容器中进行反应。在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如图所示。
(已知:容器中发生两个反应2NO(g)+O2(g)![]() 2NO2(g) H0和2NO2(g)
2NO2(g) H0和2NO2(g)![]() N2O4(g) H0)
N2O4(g) H0)
①曲线c代表__的物质的量与温度的关系,x点对应的O2的转化率为__。
②下列说法正确的是__。
A.2NO+O2![]() 2NO2的平衡常数:x点>y点
2NO2的平衡常数:x点>y点
B.y点时2NO+O2![]() 2NO2的反应速率:v正<v逆
2NO2的反应速率:v正<v逆
C.x点对应的NO的物质的量分数为![]()
D.400~1200℃时,随温度升高,N2O4体积分数不断增大
III.对NO与Cl2物反应及产物NOCl(亚硝酰氯)的研究
(4)NOCl可由NO与Cl2制得,化学方程式为2NO(g)+Cl2(g)![]() 2NOCl ΔH=-111kJ/mol。在295K时,其反应物浓度与反应速率关系的数据如下:
2NOCl ΔH=-111kJ/mol。在295K时,其反应物浓度与反应速率关系的数据如下:
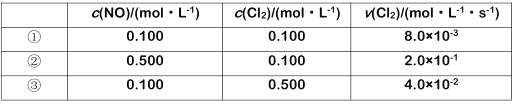
反应物浓度与反应速率关系式为v(Cl2)=k·cm(NO)cn(Cl2),式中速率常数k=Ae-Ea/RT,其中Ea为活化能,A、R均为大于0的常数,T为温度)。则此条件下k的数值为__,若要使k增大,可采取的措施有__、__。
【答案】-92 Nad+3Had=NHad+2Had或Nad+Had=NHad NO-2e-+H2O=NO2+2H+ NO2 60% AC 8 加入催化剂 升温
【解析】
由盖斯定律可知反应的焓变和反应物和生成物的能量有关,与变化过程无关,该历程中反应速率最慢的步骤是正反应活化能大的反应决定反应快慢;根据温度对平衡的影响并结合图像分析;根据速率与浓度关系的公式计算速率常数k,并结合影响速率的因素分析。
(1)由图可知合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) 的△H=-46kJ/mol,则N2(g)+3H2(g)
NH3(g) 的△H=-46kJ/mol,则N2(g)+3H2(g) ![]() 2NH3(g)的H=-46kJ/mol×2=-92kJ·mol-1;该历程中反应速率最慢的步骤是反应消耗能量高,难发生的反应,反应的化学方程式为:Nad+3Had=NHad+2Had或Nad+Had=NHad;
2NH3(g)的H=-46kJ/mol×2=-92kJ·mol-1;该历程中反应速率最慢的步骤是反应消耗能量高,难发生的反应,反应的化学方程式为:Nad+3Had=NHad+2Had或Nad+Had=NHad;
(2)由脱除NO的过程图可知,P1端NO失去电子,发生氧化反应生成NO2,反应式为NO+H2O-2e-=NO2+2H+;
(3)①曲线C对应低温下物质的量接近2mol,曲线c代表NO2的物质的量与温度的关系,x点对应NO的物质的量为0.8mol,可知转化的NO为1.2mol,参加反应的氧气为0.6mol,x点对应的O2的转化率为![]() ×100%=60%;
×100%=60%;
②A.为放热反应,温度越高K越小,则2NO+O2![]() 2NO2的平衡常数:x点>y点,故A正确;
2NO2的平衡常数:x点>y点,故A正确;
B.y点时平衡正向移动,则y点时2NO+O2![]() 2NO2的反应速率:V(正)>V(逆),故B错误;
2NO2的反应速率:V(正)>V(逆),故B错误;
C.x点对应NO的物质的量为0.8mol,由N原子守恒可知还存在0.8molNO2和0.2molN2O4,剩余氧气为0.4mol,则x点对应的NO的物质的量分数为![]() =
=![]() ,故C正确;
,故C正确;
D.400~1200℃时,随着温度升高,2NO2(g)![]() N2O4(g)△H<0逆向移动,N2O4体积分数不断减小,故D错误;
N2O4(g)△H<0逆向移动,N2O4体积分数不断减小,故D错误;
故答案为AC;
(4)已知2NO(g)+Cl2(g)![]() span>2NOCl ΔH=-111kJ/mol且v(Cl2)=k·cm(NO)cn(Cl2),当v(Cl2)=8.0×10-3mol·L-1·S-1、c(NO)=0.1 mol·L-1、c(Cl2)=0.1 mol·L-1时,k=
span>2NOCl ΔH=-111kJ/mol且v(Cl2)=k·cm(NO)cn(Cl2),当v(Cl2)=8.0×10-3mol·L-1·S-1、c(NO)=0.1 mol·L-1、c(Cl2)=0.1 mol·L-1时,k=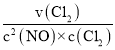 =
=![]() =8;k=Ae-Ea/RT,其中Ea为活化能,A、R均为大于0的常数,T为温度,欲改变速率常数k,需要改变活化能或温度,则若要使k增大,可采取的措施有使用催化剂降低反应活化能或升高温度。
=8;k=Ae-Ea/RT,其中Ea为活化能,A、R均为大于0的常数,T为温度,欲改变速率常数k,需要改变活化能或温度,则若要使k增大,可采取的措施有使用催化剂降低反应活化能或升高温度。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案