��Ŀ����
A��B��C��D��EΪǰ��������ԭ���������������Ԫ�أ���ص���Ϣ���£�
���ö�Ӧ��Ԫ�ط��Żش��������⣺
��1��A������γ�һ�ֵķ���ʽΪA2H4������÷����д��ڦҼ���м���Ŀ��Ϊ ��
��2��H��A��H��B���ֹ��ۼ��У����ܽϴ���� ��H��A��H��D���ֹ��ۼ��У����ļ��Խ�ǿ����
��3��Eλ�����ڱ��е�λ���� ������E��B������������ˮ�����ϡ��Һ��Ӧ�����ӷ���ʽΪ ��
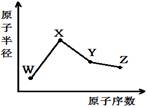
��4���������������仯ʾ��ͼ����д��BO��AO2��Ӧ���Ȼ�ѧ����ʽ ��

��5��C������������Ӧ��ˮ����ΪM��M�к��еĻ�ѧ������Ϊ ����һ������D2ͨ��һ��Ũ��M��ˮ��Һ�У�����ǡ����ȫ��Ӧʱ���������������ֺ�DԪ�ص����ӣ������������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯ʾ��ͼ����ͼ��ʾ����д��t2ʱ���ܷ�Ӧ����ʽ
| Ԫ�� | �����Ϣ |
| A | AԪ��ԭ�Ӻ���ֻ�������ܼ�����ÿ���ܼ��Ϻ�����ȵĵ����� |
| B | �ǿ����к�����ḻ��Ԫ�� |
| C | �������У�����C�Ľ�������ǿ |
| D | ��̬ԭ�ӵ����ܲ�����7���˶�״̬��ͬ�ĵ��� |
| E | һ�ֺ��ص�������Ϊ63��������Ϊ34 |
���ö�Ӧ��Ԫ�ط��Żش��������⣺
��1��A������γ�һ�ֵķ���ʽΪA2H4������÷����д��ڦҼ���м���Ŀ��Ϊ ��
��2��H��A��H��B���ֹ��ۼ��У����ܽϴ���� ��H��A��H��D���ֹ��ۼ��У����ļ��Խ�ǿ����
��3��Eλ�����ڱ��е�λ���� ������E��B������������ˮ�����ϡ��Һ��Ӧ�����ӷ���ʽΪ ��
��4���������������仯ʾ��ͼ����д��BO��AO2��Ӧ���Ȼ�ѧ����ʽ ��

��5��C������������Ӧ��ˮ����ΪM��M�к��еĻ�ѧ������Ϊ ����һ������D2ͨ��һ��Ũ��M��ˮ��Һ�У�����ǡ����ȫ��Ӧʱ���������������ֺ�DԪ�ص����ӣ������������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯ʾ��ͼ����ͼ��ʾ����д��t2ʱ���ܷ�Ӧ����ʽ
25��5:1��2�֣�
��H-C ��2�֣� H-Cl��2�֣� ��һ����H-C��H-N���ɣ�
�ǵ������ڵ�IB �� ��2�֣�
3Cu + 8H+ + 2NO3- = 3Cu2++2NO�� + 4H2O��2�֣� д����ͨ��ѧ����ʽ�����÷֣����ӷ��Ż�ѧʽ�������÷֣���ƽ������1�֡�
��NO(g)+ CO2(g)=NO2(g)+CO(g)
��H ="+234" kJ/mol��2�֣� ����ȷ��������״̬����H����ֵ����+���ż���λ����һ�������÷֡�
�����Ӽ������Լ� ��2�֣� ��1�֣������Լ���д�ɡ����ۼ������Թ��ۼ���Ҳ�ɡ������������ͣ�ÿ����һ����1�֡�
5Cl2��10NaOH = 7NaCl��2NaClO��NaClO3��5H2O��2�֣� д���ӷ���ʽҲ�ɡ���ѧʽ�������ӷ��ţ��������÷֣���ƽ������1�֡�
���������
������Ϣ������֪A��B��C��D��E�ֱ�ΪC��N��Na��Cl��CuԪ�ء�
��1��A2H4Ϊ��ϩ����ṹ��ʽΪCH2=CH2����Ҽ���м����ֱ�Ϊ5��1����֮��Ϊ5:1��
��2�����ܸ������й�ϵ����Խ�ϣ�����Խ�ߣ�����H��C<H��N�����Ը��縺���йأ��縺��Խ��������Խ����Խǿ����H��C<H��Cl��
��3��ΪCu��ϡ����ķ�Ӧ
��4����ͼ�п��Կ���������������������ڷ�Ӧ�����������ʸ÷�ӦΪ���ȷ�Ӧ�����С�H ="+234" kJ/mol��
��5��NaOH��������Ӧ��������Cl-��ClO-��Cl-��ClO3-����ͼ�п���n(ClO-):n(ClO3-)=2:1���Ӷ�д����Ӧ����ʽ��

��ϰ��ϵ�д�
�����Ŀ
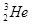 �˾۱����ͷų��������൱��Ŀǰ����һ�����ĵ��������ڵ����Ϻ�Ԫ����Ҫ��
�˾۱����ͷų��������൱��Ŀǰ����һ�����ĵ��������ڵ����Ϻ�Ԫ����Ҫ��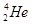 ����ʽ���ڡ��йظ�Ԫ��˵����ȷ����
����ʽ���ڡ��йظ�Ԫ��˵����ȷ����
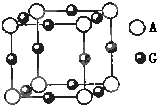 ��������٤������ΪNA���û����ᄃ����ܶ�Ϊ a g/cm3���侧���ı߳�Ϊ cm��
��������٤������ΪNA���û����ᄃ����ܶ�Ϊ a g/cm3���侧���ı߳�Ϊ cm��