题目内容
【题目】氢化阿托醛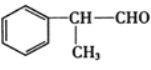 是一种重要的化工原料,其合成路线如图:
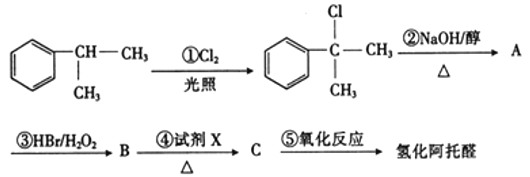
是一种重要的化工原料,其合成路线如图:
已知:HBr+CH3-CH=CH2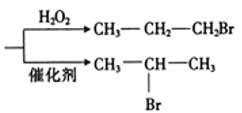
请根据上述合成路线,回答下列问题:
(1)一定条件下,1 mol氢化阿托醛最多可跟___mol氢气加成。
(2)②的反应类型是_______。写出它的化学方程式:______。
(3)④中所用试剂X为_______。
(4)写出反应⑤的化学方程式:_______。
【答案】4 消去反应  +NaOH
+NaOH![]()
![]() +NaCl+H2O 氢氧化钠溶液 2
+NaCl+H2O 氢氧化钠溶液 2![]() +O2→2
+O2→2![]() +2H2O
+2H2O
【解析】
根据题中各物质的转化关系,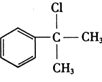 在氢氧化钠醇溶液中发生消去反应生成A为
在氢氧化钠醇溶液中发生消去反应生成A为![]() ,A与溴化氢在双氧水条件下发生信息中的反应生成B为
,A与溴化氢在双氧水条件下发生信息中的反应生成B为![]() ,B在氢氧化钠水溶液中发生水解生成C为
,B在氢氧化钠水溶液中发生水解生成C为![]() ,C发生氧化反应生成氢化阿托醛(
,C发生氧化反应生成氢化阿托醛(![]() ),据以上分析进行解答。
),据以上分析进行解答。
根据题中各物质的转化关系, 在氢氧化钠醇溶液中发生消去反应生成A为
在氢氧化钠醇溶液中发生消去反应生成A为![]() ,A与溴化氢在双氧水条件下发生信息中的反应生成B为
,A与溴化氢在双氧水条件下发生信息中的反应生成B为![]() ,B在氢氧化钠水溶液中发生水解生成C为
,B在氢氧化钠水溶液中发生水解生成C为![]() ,C发生氧化反应生成氢化阿托醛(
,C发生氧化反应生成氢化阿托醛(![]() );
);
(1)由于氢化阿托醛中有一个苯环和一个醛基,1mol苯基最多与3mol氢气发生加成,1mol醛基与1mol氢气发生加成,所以一定条件下,1mol氢化阿托醛最多可跟4mol氢气加成;
故答案为:4;
(2)反应②为 在氢氧化钠醇溶液中发生消去反应生成
在氢氧化钠醇溶液中发生消去反应生成![]() ,反应的方程式为:
,反应的方程式为: +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O;
故答案为:消去反应; +NaOH
+NaOH![]()
![]() +NaCl+H2O
+NaCl+H2O
(3)根据上面分析可知,④中所用试剂X为氢氧化钠溶液;
故答案为:氢氧化钠溶液;
(4)C为![]() ,C发生氧化反应生成氢化阿托醛(
,C发生氧化反应生成氢化阿托醛(![]() ) ,反应的方程式为:2
) ,反应的方程式为:2![]() +O2→2
+O2→2![]() +2H2O;
+2H2O;
故答案为:2![]() +O2→2
+O2→2![]() +2H2O。
+2H2O。

练习册系列答案
相关题目