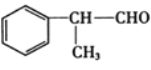
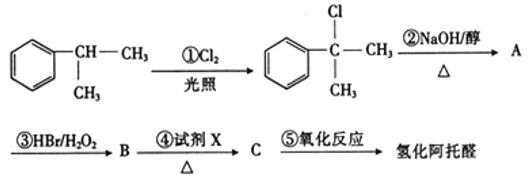
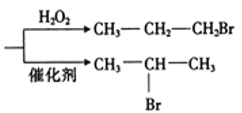
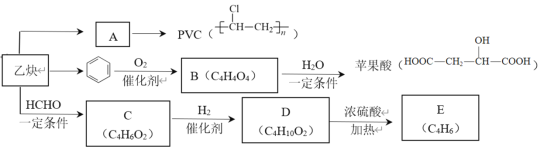
题目内容
【题目】对烟道气中的SO2进行吸收或回收再利用具有一定的社会和经济价值。
请回答下列问题:
(1)用NaOH溶液吸收SO2 ,写出相关反应的离子方程式_______________________。
(2)已知NaHSO3溶液显酸性,比较NaHSO3溶液中c(H2SO3)_____ c(SO32-)(填“>”“<”或“=”),请简述判断理由____________________________________________。
烟道气中的SO2,也可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(s)+2CO2(g) + Q kJ。某温度下,在2 L恒容密闭容器中通入2 mol SO2和一定量的CO,发生上述反应,5 min后达到平衡,生成1 mol CO2。
S(s)+2CO2(g) + Q kJ。某温度下,在2 L恒容密闭容器中通入2 mol SO2和一定量的CO,发生上述反应,5 min后达到平衡,生成1 mol CO2。
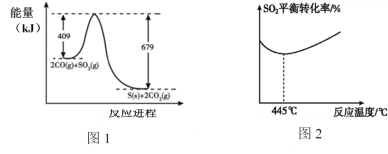
(3)一定条件下,上述反应的能量变化如图1,则 Q =_________kJ。
(4)写出该反应平衡常数表达式________;0~5min内SO2的平均反应速率为________。
(5)对反应2CO(g)+SO2(g)![]() S(s)+2CO2(g) + Q kJ的分析正确的是_______。
S(s)+2CO2(g) + Q kJ的分析正确的是_______。
a.若混合气体密度保持不变,则反应已达平衡状态
b.从反应开始到平衡时,容器内气体的压强保持不变
c.平衡时,其它条件不变,分离出硫,正反应速率加快
d.平衡时,其它条件不变,再充入一定量CO2,平衡常数保持不变
(6)其他条件不变时,随着温度的升高,SO2的平衡转化率随温度的变化曲线如图2所示,请解释其可能的原因________________________________。(已知硫的沸点约是445°C)
【答案】![]() 或
或![]() < HSO3-既能水解生成H2SO3和OH- ,HSO3-又能电离生成SO32-和H+ ,已知NaHSO3溶液呈酸性,说明HSO3-的电离程度大于水解程度,所以c(H2SO3)< c(SO32-) 270 K=
< HSO3-既能水解生成H2SO3和OH- ,HSO3-又能电离生成SO32-和H+ ,已知NaHSO3溶液呈酸性,说明HSO3-的电离程度大于水解程度,所以c(H2SO3)< c(SO32-) 270 K=![]() 0.05mol/(Lmin) ad 正反应放热,温度升高平衡逆向移动,SO2平衡转化率降低;温度高于445 ℃后硫变成气态,硫变为硫蒸气需要吸热,使得反应变为吸热反应,温度升高平衡正向移动,SO2平衡转化率升高
0.05mol/(Lmin) ad 正反应放热,温度升高平衡逆向移动,SO2平衡转化率降低;温度高于445 ℃后硫变成气态,硫变为硫蒸气需要吸热,使得反应变为吸热反应,温度升高平衡正向移动,SO2平衡转化率升高
【解析】
(1) SO2与NaOH反应生成Na2SO3或NaHSO3;
(2) NaHSO3溶液显酸性,说明![]() 的电离程度大于水解过程;
的电离程度大于水解过程;
(3)由题可知,根据反应吸收和放出的能量的差值来判断;
(4)由反应的方程式可知,写出该反应的平衡常数表达式;5min时,生成CO21mol,所以消耗了0.5mol的SO2,据![]() 计算反应速率;
计算反应速率;
(5) 对反应2CO(g)+SO2(g)![]() S(s)+2CO2(g),该反应在恒容条件下达到平衡,气体的体积恒定,反应前后气体的总质量发生变化,气体的总量也发生变化,但是平衡常数的变化只与温度有关,据以上分析解答;
S(s)+2CO2(g),该反应在恒容条件下达到平衡,气体的体积恒定,反应前后气体的总质量发生变化,气体的总量也发生变化,但是平衡常数的变化只与温度有关,据以上分析解答;
(6)由题可知,温度若低于445℃,该反应为放热反应,升高温度会导致平衡逆向移动,SO2转化率下降;温度若高于445℃,S单质会气化,气化是吸热的过程,可能会使反应由放热反应转变为吸热反应,从而升高温度变得对反应正向进行有利。
(1)NaOH为强碱,离子方程式中可以拆分,若SO2少量则生成Na2SO3,若SO2过量,则生成NaHSO3;相关的离子方程式为![]() 和
和![]() ;
;
(2)![]() 是弱酸的酸式酸根,在水溶液中既能发生电离,也能发生水解;由于NaHSO3溶液显酸性,说明
是弱酸的酸式酸根,在水溶液中既能发生电离,也能发生水解;由于NaHSO3溶液显酸性,说明![]() 的电离程度更大,因此溶液中
的电离程度更大,因此溶液中![]() 的浓度相比于
的浓度相比于![]() 更大;
更大;
(3)由题可知,回收硫的反应是放热反应,在生成硫单质,CO2的同时也产生了一部分热量,反应前物质的总能量比反应后产物的总能量高出270kJ,因此,Q=270kJ;
(4)由反应的方程式可知,该反应的平衡常数表达式为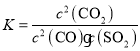 ;5min时,生成CO21mol,所以消耗了0.5mol的SO2,所以反应速率为:
;5min时,生成CO21mol,所以消耗了0.5mol的SO2,所以反应速率为:![]() ;
;
(5)a.该反应在恒容条件下达到平衡,气体的体积恒定;该反应涉及的物质不全为气体,所以气体的质量会随反应进行发生变化;若气体的密度不再变化,则由公式![]() 可知,气体的质量不再变化,那么反应一定达到了平衡状态,a项正确;
可知,气体的质量不再变化,那么反应一定达到了平衡状态,a项正确;
b.该反应反应物中气体的化学计量系数之和与产物中气体的化学计量系数之和不相等,因此气体的总物质的量会随反应进行发生变化,又因为该反应是在恒容恒温条件下达到的平衡;根据公式![]() 可知,容器内的压强会随着反应进行发生变化直至反应达到平衡,b项错误;
可知,容器内的压强会随着反应进行发生变化直至反应达到平衡,b项错误;
c.其他条件不变时,仅从体系内分离出S单质,不影响平衡的移动,对于正逆反应速率无影响,c项错误;
d.平衡常数认为只与温度有关,温度不变,所以平衡常数不变,d项正确;
答案选ad;
(6)由题可知,温度若低于445℃,该反应为放热反应,升高温度会导致平衡逆向移动,SO2转化率下降;温度若高于445℃,S单质会气化,气化是吸热的过程,可能会使反应由放热反应转变为吸热反应,从而升高温度变得对反应正向进行有利,SO2的转化率也就逐渐升高。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO 还原 NO 的反应为 2CO(g)+ 2NO(g)2CO2 (g)+ N2 (g) H= -746kJmol-1。部分化学键的键能数据如下表(CO 以 C≡O 键构成):
化学键 | C≡O | N≡N | C=O |
E/(kJ·mol-1) | 1076 | 945 | 745 |
① 由以上数据可求得 NO 的键能为________________kJ·mol-1。
② 写出两条有利于提高 NO 平衡转化率的措施______________。
(2)一定条件下,向某恒容密闭容器中充入 x mol CO2 和 y mol H2,发生的反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 50 kJmol1。
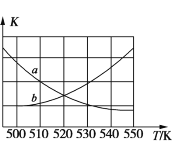
①图中能表示该反应的平衡常数 K 与温度 T 之间的变化关系曲线为____________ (填“a”或“b”),其判断依据是________ 。
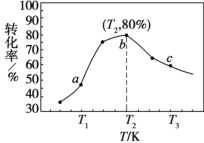
②若 x=2、y=3,测得在相同时间内不同温度下 H2 的转化率如图所示,则在该时间段内, 恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为________。
(3)在有氧条件下,新型催化剂 M 能催化 NH3 与 NOx 反应生成 N2。
① NH3 与 NO2 生成 N2 的反应中,当生成 28g N2 时,转移的电子数为_______________mol(结果保留三位有效数字)。
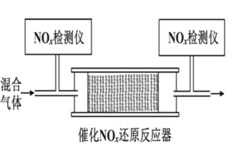
② 将一定比例的 O2、NH3 和 NOx 的混合气体,匀速通入装有催化剂 M 的反应器中反应(装置如图)。
反应相同时间 NOx 的去除率随反应温度的变化曲线如图所示:
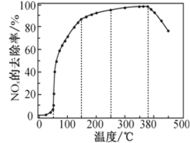
在 50~250 ℃范围内随着温度的升高,NOx 的去除率先迅速上升后上升缓慢的主要原因是_______________;当反应温度高于 380 ℃时,NOx 的去除率迅速下降的原因可能是_________。