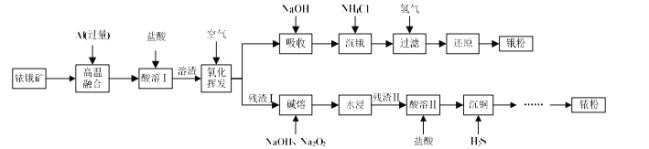
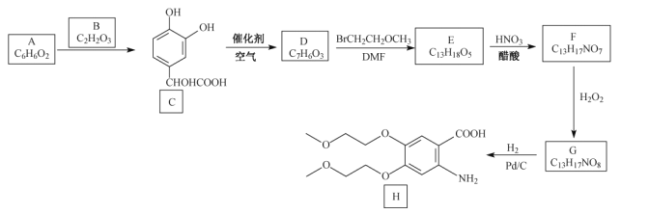
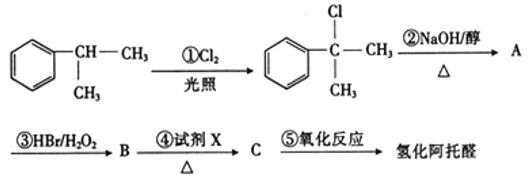
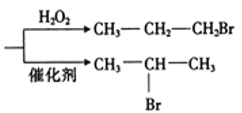
题目内容
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
I.可利用CH4与CO2制备合成气(CO、H2),在某一钢性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-A12O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)
(1)研究表明CO的生成速率![]() ,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=_________。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
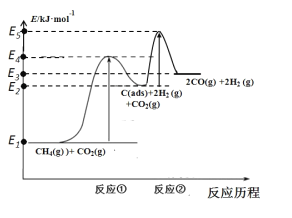
CH4与CO2制备合成气的热化学方程式为__________________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.CO2催化加氢制甲醇5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
i. ![]() ,
,![]()
ii.. ![]()
iii. ![]()
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如右图所示。
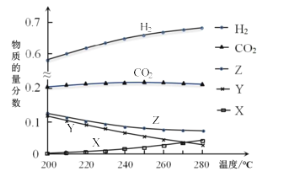
(4)①体系中CO2的物质的量分数受温度的影响不大,原因是_______________________。
②下列措施中,无法提高甲醇平衡产率的是________(填标号)。
A.加入适量CO B.增大压强C.循环利用原料气D.升高温度
③如上图X、Y分别代表_________、________(填化学式)。
III.利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
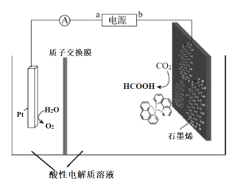
(5)①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”),阴极的电极反应式为________________。
②每转移2mol电子,阴极室溶液质量增加______g。
【答案】0.96 540(kPa)2 CH4(g) + CO2(g)![]() 2CO(g) + 2H2(g) △H=+(E3-E1) kJ·mol-1 < 温度改变时,反应i和反应ii平衡移动方向相反 D CO CH3OH 变小 CO2+2H++2e-=HCOOH 46
2CO(g) + 2H2(g) △H=+(E3-E1) kJ·mol-1 < 温度改变时,反应i和反应ii平衡移动方向相反 D CO CH3OH 变小 CO2+2H++2e-=HCOOH 46
【解析】
I.(1)在某一钢性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,某时刻测得p(H2)=10kPa,则:
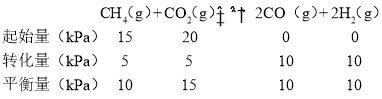
该时刻v(CO)=1.28×10-2p(CH4)p(CO2)=1.28×10-2×10×15=1.92,则v(CH4)=![]() v(CO)=1.92×
v(CO)=1.92×![]() =0.96;
=0.96;
(2)达到平衡后,测得CO的产率为50%,则CO的平衡分压为15kPa;列三段式:
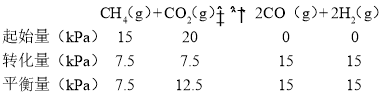
平衡常数Kp=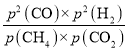 =
=![]() =540;
=540;
(3)CH4与CO2制备“合成气”的化学方程式为CH4(g)+CO2(g)2H2(g)+2CO(g),由图可知反应的焓变△H=生成物的总内能-反应物的总内能=(E3-E1)kJ/mol,反应的热化学方程式为CH4(g)+CO2(g)2H2(g)+2CO(g)△H=+(E3-E1)kJ/mol;两步历程中反应①是慢反应,所以反应①的活化能大于反应②的活化能,即E4-E1>E5-E2,所以E5+E1<E4+E2;
II.(4)△H1<0,△H3<0,即生成甲醇的反应均为放热反应,所以温度升高平衡时甲醇的物质的量分数应减小,△H2>0,生成CO的反应为吸热反应,所以随温度升高CO平衡时的物质的量分数会变大,二者共同作用导致水蒸气减小幅度小于甲醇,所以Z代表H2O,Y代表CH3OH,X代表CO;
①依据主要反应的化学方程式可知,反应i消耗CO2,反应ii逆向产生CO2,最终体系内CO2的物质的量分数与上述两个反应进行的程度相关。由于△H1<0而△H2>0,根据勒夏特列原理,温度改变时,反应i和反应ii平衡移动方向相反,且平衡移动程度相近,导致体系内CO2的物质的量分数受温度的影响不大;
②A.加入适量CO,促使反应iii平衡正向移动,产生更多的CH3OH,而反应ii平衡逆向移动,又可减少CO2转化为CO,使更多的CO2通过反应i转化为CH3OH,故CH3OH产率提高,故A正确;
B.增大压强,有利于反应i和iii的平衡正向移动,而对反应ii无影响,故B正确;
C.循环利用原料气能提高CO2的转化率,使CH3OH的产率提高,故C正确;
D.由图可知,升温,CH3OH的物质的量分数下降,产率降低,故D错误;
故答案为D;
③根据分析可知X代表CO,Y代表CH3OH;
III.石墨烯的表面CO2发生还原反应,说明石墨烯为阴极,则b为电源的负极;
(5)①电池工作过程中,Pt电极为阳极,发生的电极反应式为2H2O-4e-=O2↑+4H+,则附近溶液的pH变小,阴极上发生还原反应的电极反应式为CO2+2H++2e-=HCOOH;
②每转移2mol电子,由阴极电极反应式CO2+2H++2e- =HCOOH可知,生成1molHCOOH,质量为46g/mol×1mol=46g,即阴极室溶液质量增加46g。

 阅读快车系列答案
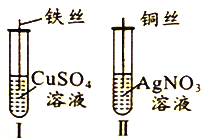
阅读快车系列答案【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。
【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO
【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO 还原 NO 的反应为 2CO(g)+ 2NO(g)2CO2 (g)+ N2 (g) H= -746kJmol-1。部分化学键的键能数据如下表(CO 以 C≡O 键构成):
化学键 | C≡O | N≡N | C=O |
E/(kJ·mol-1) | 1076 | 945 | 745 |
① 由以上数据可求得 NO 的键能为________________kJ·mol-1。
② 写出两条有利于提高 NO 平衡转化率的措施______________。
(2)一定条件下,向某恒容密闭容器中充入 x mol CO2 和 y mol H2,发生的反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 50 kJmol1。
①图中能表示该反应的平衡常数 K 与温度 T 之间的变化关系曲线为____________ (填“a”或“b”),其判断依据是________ 。
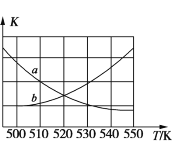
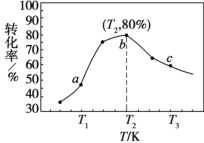
②若 x=2、y=3,测得在相同时间内不同温度下 H2 的转化率如图所示,则在该时间段内, 恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为________。
(3)在有氧条件下,新型催化剂 M 能催化 NH3 与 NOx 反应生成 N2。
① NH3 与 NO2 生成 N2 的反应中,当生成 28g N2 时,转移的电子数为_______________mol(结果保留三位有效数字)。
② 将一定比例的 O2、NH3 和 NOx 的混合气体,匀速通入装有催化剂 M 的反应器中反应(装置如图)。
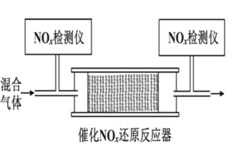
反应相同时间 NOx 的去除率随反应温度的变化曲线如图所示:
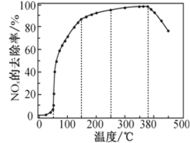
在 50~250 ℃范围内随着温度的升高,NOx 的去除率先迅速上升后上升缓慢的主要原因是_______________;当反应温度高于 380 ℃时,NOx 的去除率迅速下降的原因可能是_________。