��Ŀ����
����Ŀ���Դ�����Ⱦ��NOx�����о�������Ҫ�������塣
��1����֪��������������NO�ķ�ӦΪ��N2(g)��O2(g)![]() 2NO(g)��Q����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��10.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ0.02mol/L����ش��������⣺5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2)��_____________�� ���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���ǣ�______________________________��
2NO(g)��Q����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��10.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ0.02mol/L����ش��������⣺5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2)��_____________�� ���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���ǣ�______________________________��
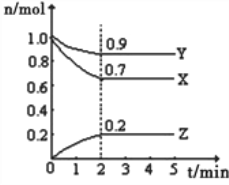
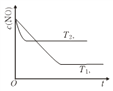
��2����ͼ��ʾ��������������ʱ����Ӧ2NO(g)��2CO(g)![]() 2CO2(g)��N2(g) �У�NO��Ũ��c(NO)�ڲ�ͬ�¶�(T)����ʱ��(t)�ı仯���ߡ���ƽ�������ӦΪ_________��Ӧ (����ȡ����ȡ�)��
2CO2(g)��N2(g) �У�NO��Ũ��c(NO)�ڲ�ͬ�¶�(T)����ʱ��(t)�ı仯���ߡ���ƽ�������ӦΪ_________��Ӧ (����ȡ����ȡ�)��
��3��Ϊ�˼�������β���Ի�������Ⱦ���ɲ�ȡ�Ĵ�ʩ________________________����дһ������
��һ���棬�����������Ϊ���������������������
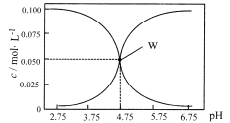
��4����ˮ��һ�ֺܺõĵ��ʣ������²ⶨ0.1mol/L��ˮ��Һ����pHֵС��13����ԭ����_____���õ��뷽��ʽ���ͣ�����������������______________���о���������
��5�������������ˮ����ˮ��Һ�� ________������ԡ��������ԡ��������ԡ�����ԭ����____________ (�����ӷ���ʽ��ʾ)��
���𰸡� 2.0��10-3mol/(L��s) ����Ӧ��һ�����ȷ�Ӧ���¶����߷�Ӧ��������ͬʱƽ�������ƶ���ʹ��λʱ����NO���ŷ������� ���ȷ�Ӧ �Ľ�������ȼ�շ�ʽ���Ա���������ȫȼ�գ���ʹ�ô�������װ�ã�ʹ�к�����ת���������壻��ʹ����Ǧ���ͣ���ֹ��Ǧ�������ŷţ�����ɫ���� NH3��H2O![]() NH4++OH- �̬���ʡ���̬���ʡ��л����� ���� NH4++H2O
NH4++OH- �̬���ʡ���̬���ʡ��л����� ���� NH4++H2O![]() NH3��H2O+H+
NH3��H2O+H+
����������1��1300oCʱ��10.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ0.02mol/L, �����ı仯Ũ��Ϊ0.02/2=0.01 mol/L,5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2)��0.01/5=2.0��10-3mol/(L��s) �����ڸ÷�Ӧ����Ӧ��һ�����ȷ�Ӧ���¶����߷�Ӧ��������ͬʱƽ�������ƶ���ʹ��λʱ����NO���ŷ����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ����ȷ�𰸣�2.0��10-3mol/(L��s) ������Ӧ��һ�����ȷ�Ӧ���¶����߷�Ӧ��������ͬʱƽ�������ƶ���ʹ��λʱ����NO���ŷ������� ��
��2������ͼ���ȹ���ƽ�����ߡ��Ĺ��ɿ�֪���¶�T2����T1���¶���T1��T2��һ��������Ũ������ƽ�����ƣ��÷�Ӧ����ӦΪ���ȷ�Ӧ����ȷ�𰸣����ȷ�Ӧ��
��3��Ϊ�˼�������β���Ի�������Ⱦ���ɲ�ȡ�Ĵ�ʩ�У��Ľ�������ȼ�շ�ʽ���Ա���������ȫȼ�գ���ʹ�ô�������װ�ã�ʹ�к�����ת���������壻��ʹ����Ǧ���ͣ���ֹ��Ǧ�������ŷţ�����ɫ���У���ȷ�𰸣��Ľ�������ȼ�շ�ʽ���Ա���������ȫȼ�գ���ʹ�ô�������װ�ã�ʹ�к�����ת���������壻��ʹ����Ǧ���ͣ���ֹ��Ǧ�������ŷţ�����ɫ���С�
��4��һˮ�ϰ�Ϊ������ʣ���ˮ�в��ַ������룺NH3��H2O![]() NH4++OH- �������Һ��c(OH-)С��0.1mol/L����pHֵС��13�����������������̬���ʡ���̬���ʡ��л����ʣ���ȷ�𰸣�NH3��H2O
NH4++OH- �������Һ��c(OH-)С��0.1mol/L����pHֵС��13�����������������̬���ʡ���̬���ʡ��л����ʣ���ȷ�𰸣�NH3��H2O![]() NH4++OH- ���̬���ʡ���̬���ʡ��л����ʡ�
NH4++OH- ���̬���ʡ���̬���ʡ��л����ʡ�
5�������Ϊǿ�������Σ�ˮ�������ԣ�笠�����ˮ������һˮ�ϰ��������ӣ����ӷ���ʽ ΪNH4++H2O![]() NH3��H2O+H+����ȷ�𰸣����ԣ�NH4++H2O
NH3��H2O+H+����ȷ�𰸣����ԣ�NH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��