题目内容
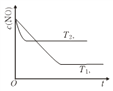
【题目】25℃时,有c(HA)+c(A-)=0.1mol/L 的一组HA、KA 混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是
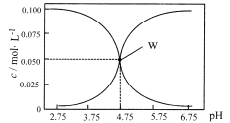
A. pH= 5.75 的溶液中: c(K+)>c(A- )>c(HA)>q(H+)>c(OH- )
B. 欲得W 点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L 且c(KA)
C. pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D. 若A-的水解常数为Kb 则lgKb=-9.25
【答案】A
【解析】pH=5.75的溶液呈酸性,c(K+)>c(A-)>c(HA)>q(H+)>c(OH-)不符合电荷守恒,故A错误;根据W点,HA的电离平衡常数是![]() ,A-的水解平衡常数为
,A-的水解平衡常数为![]() ,HA电离大于A-水解,欲得W点所示溶液,c(KA)<c(HA),故B正确;c(HA)+c(A-)=0.1mol/L,c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L,则c(K+)+c(H+)= c(A-)+ c(OH-),符合电荷守恒,故C正确;根据B选项,A-的水解平衡常数为
,HA电离大于A-水解,欲得W点所示溶液,c(KA)<c(HA),故B正确;c(HA)+c(A-)=0.1mol/L,c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L,则c(K+)+c(H+)= c(A-)+ c(OH-),符合电荷守恒,故C正确;根据B选项,A-的水解平衡常数为![]() ,lgKb=-9.25,故D正确。
,lgKb=-9.25,故D正确。

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目