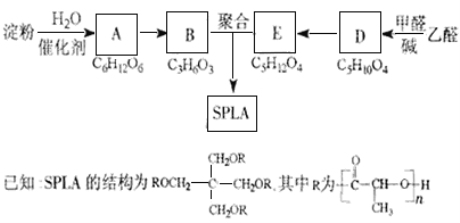
题目内容
【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
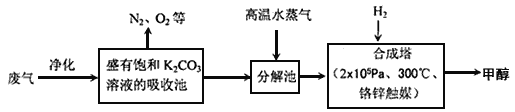
(1)吸收池中反应的化学方程式为K2CO3+CO2+H2O=2KHCO3,△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,其原因是 ____________________,_________________________
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____________。
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为___________________
(2)下列描述能说明反应达到平衡![]() 是_______
是_______
A.装置内CO和H2的浓度比值不再改变
B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变
D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
【答案】提高反应速率 增大催化剂催化活性 CO2(g) +4H2(g)=CH4(g) +2H2O(l) △H=-252.9kJ·mol-1 0.0125mol·L-1·min-1 BC 4 不变 增大
【解析】
I(1)根据工艺流程可知,合成塔内反应是氢气与二氧化碳反应生成甲醇和水;工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol,②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol,根据盖斯定律构造目标热化学方程式;
II. (1)从反应开始到20min时,设CO的浓度变化量是x,CO(g)+2H2(g)![]() CH3OH(g),利用三段式进行分析;
CH3OH(g),利用三段式进行分析;
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,以及其它物理量的变化情况,可由此进行判断;
(3)平衡常数是利用平衡状态下生成物浓度幂次方乘积除以反应物浓度的幂次方乘积得到;平衡常数随温度变化;
(4)该反应达到平衡后,再向容器中充入1molCO22molH2,相当于增大平衡压强,平衡向气体体积减小的方向进行。
I(1)温度影响催化剂的活性,除考虑温度对反应速率的影响外,还主要考虑了催化剂的催化活性,无论是否加入催化剂,反应热都不变,只与反应物与生成物有关,
故答案为:提高反应速率;增大催化剂催化活性;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol,
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol,
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式可
根据盖斯定律②×2①得CO2(g) +4H2(g)=CH4(g) +2H2O(l) △H=-252.9kJ·mol-1,
故答案为:CO2(g) +4H2(g)=CH4(g) +2H2O(l) △H=-252.9kJ·mol-1;
II. (1)从反应开始到20min时,设CO的浓度变化量是x,
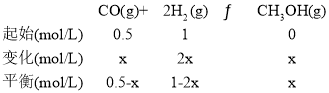
根据反应前后压强之比等于物质的量之比,则![]() ,解得x=0.25mol/L,从反应开始到20min时,CO表示的平均反应速率v=△c÷△t=0.25mol/L÷20min=0.0125mol/(Lmin),
,解得x=0.25mol/L,从反应开始到20min时,CO表示的平均反应速率v=△c÷△t=0.25mol/L÷20min=0.0125mol/(Lmin),
故答案为:0.0125mol·L-1·min-1;
(2)反应是气体体积减小的放热反应,依据平衡移动原理分析判断
A.开始充入 1mol CO和2mol H2,浓度之比等于化学计量数之比,转化的一氧化碳和氢气的浓度之比等于化学计量数之比,所以任意时刻CO和H2的浓度比值不会改变,不能说明反应达到平衡状态,故A错误;
B.容器内气体的平均相对分子质量数值上等于气体的平均摩尔质量等于总质量除以总物质的量,质量是守恒的保持不变,但是n变化,当气体的平均摩尔质量不变了,证明达到平衡,故B正确;
C.反应是前后气体体积变化的反应,容器中气体的压强保持不变,证明达到了平衡,故C正确;
D.该反应在恒容条件下进行,反应前后气体质量守恒,所以反应过程中密度始终保持不变,所以密度不变不能说明反应达到平衡状态,故D错误;
故答案为:BC;
(3)从反应开始到20min时,设CO的浓度变化量是x,
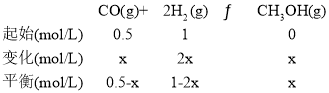
根据反应前后压强之比等于物质的量之比,则![]() ,解得x=0.25mol/L,K=0.25÷(0.25×0.52)=4,平衡常数随温度变化,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将不变,
,解得x=0.25mol/L,K=0.25÷(0.25×0.52)=4,平衡常数随温度变化,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将不变,
故答案为:4;不变;
(4) CO(g)+2H2(g)![]() CH3OH(g),该反应达到平衡后,再向容器中充入1mol CO和2mol H2,相当于增大平衡压强,平衡正向进行,CO的转化率将增大,
CH3OH(g),该反应达到平衡后,再向容器中充入1mol CO和2mol H2,相当于增大平衡压强,平衡正向进行,CO的转化率将增大,
故答案为:增大。

【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
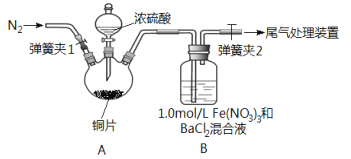
(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。