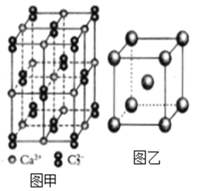
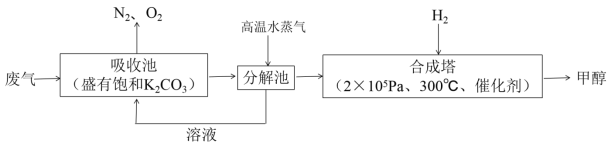
题目内容
【题目】为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸,然后关闭活塞b。
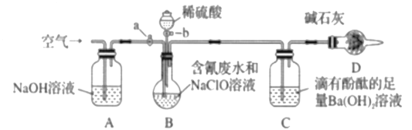
已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-、2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
(1)B中盛装稀硫酸的仪器的名称是_____________。
(2)装置D的作用是_________________,装置C中的实验现象为______________。
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为_________mg·L1。
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN的含量__________(选填“偏大”、“偏小”、“不变”)。
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为_________________。
(5)除去废水中CN的一种方法是在碱性条件下,用H2O2将CN氧化生成N2,反应的离子方程式为_____________________________。
【答案】分液漏斗 防止空气中的CO2进入装置C中 有白色沉淀生成,溶液的红色逐渐变浅(或褪去) 78 偏大 Cl+ClO+2H+=Cl2↑+H2O 5H2O2+2CN=N2↑+2HCO3-+4H2O(或5H2O2+2CN+2OH=N2↑+2CO32-+6H2O)
【解析】
实验的原理是利用CN+ClO=CNO+Cl;2CNO+2H++3ClO=N2↑+2CO2↑+3Cl+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,装置A是除去通入空气中所含二氧化碳,装置B中的反应是CN+ClO=CNO+Cl;2CNO+2H++3ClO=N2↑+2CO2↑+3Cl+H2O,通过装置C吸收生成的二氧化碳,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰。
(1)B中盛装稀硫酸的仪器的名称是分液漏斗,故答案为:分液漏斗;
(2)实验的原理是利用CN+ClO=CNO+Cl;2CNO+2H++3ClO=N2↑+2CO2↑+3Cl+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,故答案为:防止空气中的CO2和水蒸气进入C装置;有白色沉淀生成,溶液的红色逐渐变浅(或褪去);
(3)①依据反应CN+ClO=CNO+Cl;2CNO+2H++3ClO=N2↑+2CO2↑+3Cl+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成59.1mg沉淀为BaCO3↓物质的量=![]() =3×104mol,根据关系式:CNCNOCO2BaCO3↓,n(CN)= n(BaCO3)= 3×104mol,c(CN)=
=3×104mol,根据关系式:CNCNOCO2BaCO3↓,n(CN)= n(BaCO3)= 3×104mol,c(CN)=![]() =0.078g/L=78g/L,故答案为:78;
=0.078g/L=78g/L,故答案为:78;
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,空气中二氧化碳也会和氢氧化钡溶液反应,生成碳酸钡出的质量会增大,测定含氰废水中CN的含量偏大,故答案为:偏大;
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的气体单质为氯气,是氯离子和次氯酸根离子在酸溶液中发生氧化还原反应生成,反应的离子方程式为:Cl+ClO+2H+=Cl2↑+H2O,故答案为:Cl+ClO+2H+=Cl2↑+H2O;
(5)除去废水中CN的一种方法是在碱性条件下,用H2O2将CN氧化生成N2,结合电子守恒、原子守恒和电荷守恒书写离子方程式为:5H2O2+2CN=N2↑+2HCO3-+4H2O(或5H2O2+2CN+2OH=N2↑+2CO32-+6H2O),故答案为:5H2O2+2CN=N2↑+2HCO3-+4H2O(或5H2O2+2CN+2OH=N2↑+2CO32-+6H2O)。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】根据下列操作和现象所得到的结论正确的是( )
操作和现象 | 结论 | |
A | 向碳酸钙中加入盐酸,产生的气体经饱和碳酸氢钠溶液洗气后,再通入硅酸钠溶液,出现白色沉淀 | 利用该实验可以证明非金属性: |
B | 取少量某硫酸盐样品溶于氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 样品为硫酸铵 |
C | 向 等体积等浓度稀硫酸中分别加入少许等物质的量的 |
|
D | 加热石油分馏得 到的石蜡,将产生的气体通入酸性高锰酸钾溶液中,溶液颜色逐渐褪去 | 石油中含有烯烃 |
A.AB.BC.CD.D